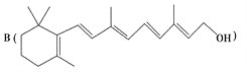
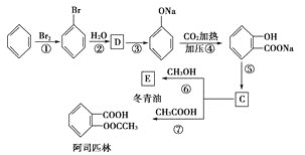
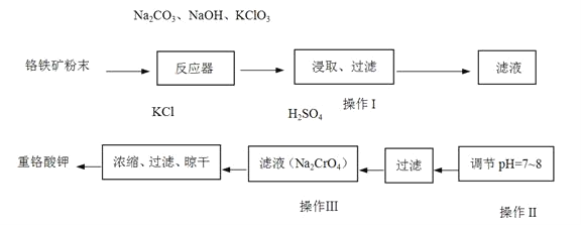
题目内容
【题目】下列离子方程式书写正确的是( )
A.FeCl3溶液腐蚀印刷电路铜板:Cu+Fe3+=Cu2++Fe2+
B.醋酸溶解鸡蛋壳:2H++CaCO3=Ca2++CO2↑+H2O
C.在NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性:Ba2++2OH-+2H++SO42-=BaSO4+2H2O
D.向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O=H2SiO3+CO32-
【答案】C
【解析】
A.选项中的方程式电荷和电子得失均不守恒,正确的离子方程式为:![]() ,A项错误;
,A项错误;
B.醋酸是弱电解质,离子方程式中不能拆分,B项错误;
C.NaHSO4溶液中加入Ba(OH)2后,溶液呈中性,说明:![]() ,由于Ba2+的量有限,所以参与反应的
,由于Ba2+的量有限,所以参与反应的![]() ,所以上述方程式正确,C项正确;
,所以上述方程式正确,C项正确;
D.通入的CO2是过量的,所以最终生成![]() ,此外,也要注意沉淀符号,正确的离子方程式为:
,此外,也要注意沉淀符号,正确的离子方程式为:![]() ,D项错误;
,D项错误;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】“C1化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH、HCOOH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2(g)和 3molH2(g) | 1mol CH3OH (g)和 1molH2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
请回答:
①a=_______________;
②若甲中反应10 s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是___________。
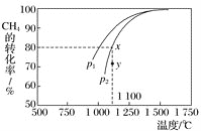
(2)甲烷的一个重要用途是制取H2,其原理为CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1_____(填“大于”或“小于”)p2;压强为p2时,在y点:v(正)______(填“大于”“小于”或“等于”)v(逆)。
2CO(g)+2H2(g)。在密闭容器中通入等物质的量浓度的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强p1_____(填“大于”或“小于”)p2;压强为p2时,在y点:v(正)______(填“大于”“小于”或“等于”)v(逆)。
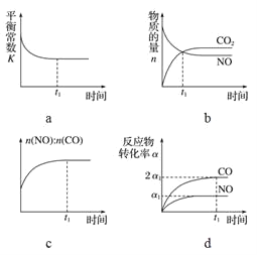
(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是________(填字母)。
2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO)∶n(CO)=2∶1的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是________(填字母)。