题目内容
20.下列原电池对应的电极反应式正确的是( )| A. | 硫酸铅蓄电池的负极:Pb-2e-═Pb2+ | |
| B. | 锌银纽扣电池的正极:Ag2O+2e-+H2O═2AgOH | |
| C. | 碱性锌锰电池的负极:Zn-2e-+2OH-═Zn(OH)2 | |
| D. | 氢氧碱性燃料电池的正极:2H2O+4e-═O2+4H+ |
分析 A、铅蓄电池是硫酸做电解质溶液,负极上是铅板放电;
B、锌银纽扣电池的正极是Ag2O;
C、碱性锌锰电池的负极是锌;
D、碱性氢氧燃料电池的正极上是氧气放电.
解答 解:A、铅蓄电池是硫酸做电解质溶液,负极上是铅板放电生成PbSO4,故负极反应为:Pb-2e-+SO42-═PbSO4,故A错误;
B、锌银纽扣电池的正极是Ag2O放电,Ag2O+2e-+H2O═2Ag+2OH-,故B错误;
C、碱性锌锰电池的负极是锌放电,由于是碱性电池,故负极反应为:Zn-2e-+2OH-═Zn(OH)2,故C正确;
D、碱性氢氧燃料电池的正极上是氧气放电,即氧气得电子,由于是碱性氢氧燃料电池,故正极反应为:O2+4e-+2H2O=4OH-,故D错误.
故选C.
点评 本题考查了常见的原电池的电极反应的书写,难度不大,注意结合放电环境来书写电极反应.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
11.下表给出了六种元素的相关信息,其中A、B、C、D、E为都周期元素.
请根据以上信息回答问题:
(1)A元素符号H F元素的名称铁.
(2)C元素在周期表中的位置第二周期VA族.
(3)D元素原子结构示意图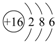 .
.
(4)E元素最高价氧化物对应水化物化学式为NaOH,其含有的化学键类型为离子键、共价键.
(5)B和D对应的气态氢化物中,热稳定性较强的是H2O,熔沸点较高的是H2O.(用具体的化学式表示)
(6)D的最高价含氧酸稀溶液与F单质反应的离子方程式Fe+2H+=Fe2++H2↑.
| 元素 | 相 关 信 息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三种必需元素之一,它能形成多种氧化物,其氢化物是中学化学里学习的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝. |
| D | 室温下其单质呈淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它在空气剧烈燃烧,有黄色火焰,生成的淡黄色固态化合物可用于潜水艇的供氧剂. |
| F | 它是人体不可缺少的微量元素,其单质也是应用最广的金属原材料,常用于制造桥梁、轨道等. |
(1)A元素符号H F元素的名称铁.
(2)C元素在周期表中的位置第二周期VA族.
(3)D元素原子结构示意图
 .
.(4)E元素最高价氧化物对应水化物化学式为NaOH,其含有的化学键类型为离子键、共价键.
(5)B和D对应的气态氢化物中,热稳定性较强的是H2O,熔沸点较高的是H2O.(用具体的化学式表示)
(6)D的最高价含氧酸稀溶液与F单质反应的离子方程式Fe+2H+=Fe2++H2↑.
8.四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
(1)W元素和氢可形成离子化合物,其电子式为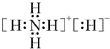 .
.
(2)Y元素和Z元素可形成YZ3化合物,可用于净水剂,净水原理Al3++3H2O=Al(OH)3(胶体)+3H+(用离子方程式表示).
(3)①下列可作为比较X和Y金属性强弱的依据是abc (填序号).
a.最高价氧化物的水化物能反应 b.相应硫酸盐水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
②由X、Y、氢、氧四种元素所组成的化合物,能与盐酸以1:4反应生成两种常见盐和水,则该化合物的化学式为NaAl(OH)4.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,混合后溶液中离子浓度由大到小的顺序是c(Na+)>c(N3-)>c(OH-)>c(H+).
| W | X | Y | Z | |
| 结构 或性质 | 最高价氧化物对应的水 化物与其气态氢化物反 应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最 低负价之和为6 |
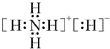 .
.(2)Y元素和Z元素可形成YZ3化合物,可用于净水剂,净水原理Al3++3H2O=Al(OH)3(胶体)+3H+(用离子方程式表示).
(3)①下列可作为比较X和Y金属性强弱的依据是abc (填序号).
a.最高价氧化物的水化物能反应 b.相应硫酸盐水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
②由X、Y、氢、氧四种元素所组成的化合物,能与盐酸以1:4反应生成两种常见盐和水,则该化合物的化学式为NaAl(OH)4.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,混合后溶液中离子浓度由大到小的顺序是c(Na+)>c(N3-)>c(OH-)>c(H+).
15.下列物质中,不属于弱电解质的是( )
| A. | CH3CHO | B. | H2CO3 | C. | CH3COOH | D. | H2C2O4 |
9.下列实验的现象、解释或结论正确的是( )
| 实验 | 解释或结论 | |
| A | 向某溶液中持续通入CO2,先出现白色胶状沉淀,通至过量,沉淀不溶解,证明存在[Al(OH)4] | Al(OH)3不溶于碳酸 |
| B | 将SO2通入紫色高锰酸钾溶液中,溶液褪色 | SO2具有还原性 |
| C | 用蒸馏法将溶解在CCl4中的碘分离出来 | 碘易升华,先分离出 |
| D | 向Fe(NO3)2溶液滴入硫酸酸化的H2O2溶液,溶液变黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
10.下列反应不属于取代反应的是( )
| A. | 苯发生硝化反应 | B. | 乙酸发生酯化反应 | ||
| C. | 乙烯水化法制乙醇 | D. | 甲烷与氯气生成四氯化碳 |
 的流程(无机试剂任用).有机合成流程示例如下:
的流程(无机试剂任用).有机合成流程示例如下: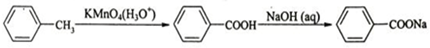
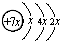 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: