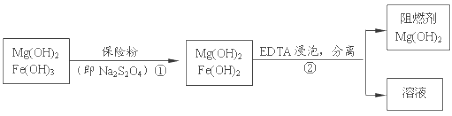
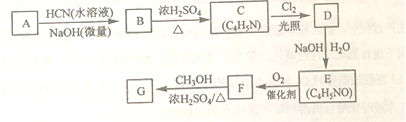
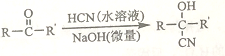
题目内容
【题目】甲醇既是重要的化工原料,又可作为燃料。利用CO2和H2在催化剂的作用下合成甲醇,主要发生的反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) H1=-53.7 kJmol-1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) H2=+41.2 kJmol-1
(1)已知化学键的键能如下:

①反应Ⅲ:CO(g)+ 2H2(g) CH3OH(g) H3=_____________。
②碳氧双键的键能为__________________。
③在某一条件下,上述反应同时发生,若反应I、Ⅱ、III的化学平衡常数分别为K1、K2、K3,则K2=____________________(用含K1、K3的形式表示)。
(2)研究表明,在催化剂存在下,CO2和H2可发生反应I和Ⅱ。某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据(甲醇选择性即转化的CO2中生成甲醇的百分数):
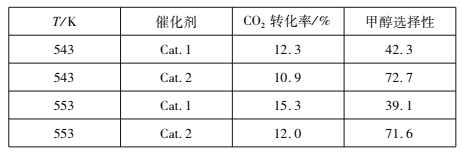
①543 K时,使用催化剂Cat.2,测得实验数据时反应I所处的状态为________________(填:“正向进行”、“平衡状态”、“逆向进行”)。
②有利于提高反应I中H2平衡转化率的措施是___________(填标号)。
A.使用催化剂Cat.1 B.降低反应温度
C.投料比不变,增加反应物的浓度 D.减小CO2和H2的初始投料比
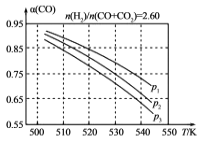
(3)在上述反应中,混合气体CO、CO2和H2的组成关系为n(H2)/n(CO+ CO2)=2.60时,体系中的CO平衡转化率α(CO)与温度和压强的关系如图所示:
①图中的压强由大到小的顺序为____________。
②α(CO)值随温度升高而变小的原因是________。
【答案】-94.9 kJ·mol-1 805.6 kJ·mol-1 K1/K3 正向进行 BC p1>p2>p3 温度升高,反应Ⅲ平衡左移,反应Ⅱ平衡右移,CO的物质的量均增大,导致CO转化率变小
【解析】
(1)本题考查盖斯定律的应用,通过盖斯定律计算反应的反应热,在化学反应过程中断开化学键吸收能量,形成新的化学键释放能量,H=断开化学键吸收能量-形成新的化学键释放能量;
(2)543 K时,使用催化剂Cat.2,甲醇的选择性高,说明反应I正向进行,通过平衡的相关知识分析反应Ⅰ;
(3)反应I正反应为放热反应,反应Ⅲ为吸热反应,需要同时考虑两个反应中的物质的变化综合分析作答。
(1)①根据盖斯定律,反应Ⅲ= 反应Ⅰ-反应Ⅱ,![]() ;②假设碳氧双键的键能为x,由反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) H2=+41.2 kJmol-1,
;②假设碳氧双键的键能为x,由反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) H2=+41.2 kJmol-1,
根据化学键的键能计算:2x+436-1076-465×2=+41.2,求出x=805.6 kJ·mol-1;③![]() ;
;![]() ;
;![]()
故答案为:①-94.9 kJ·mol-1;805.6 kJ·mol-1;K1/K3
(2) ① 543 K时,使用催化剂Cat.2,甲醇的选择性高,说明反应I正向进行;②A.使用催化剂Cat.1只能改变速率,不能使平衡移动,故A错误;B. 反应I为放热反应,降温有利于平衡正向移动,氢气转化率增大,故B正确;C. 投料比为1:2.2,化学计量数比为1:3,投料比不变增大投料量,相当于增大了反应物中CO2的比例,平衡正向移动,氢气转化率增加,故C正确;D. 减小CO2和H2的初始投料比,相当于增大了氢气的初始量,氢气的转化率会降低,故D错误;本题选BC。故答案为:①正向进行;②BC。
(3)①由图可知,压强一定时,随温度的升高,CO的转化率减小,反应I正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应Ⅲ为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,随温度升高,CO的转化率减小;相同温度下,反应Ⅲ前后气体分子数不变,压强改变不影响其平衡移动,反应I正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高,故压强:P1>P2>P3;②反应I正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应Ⅲ为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小;故答案为:①P1>P2>P3;②温度升高,反应Ⅲ平衡左移,反应Ⅱ平衡右移,CO的物质的量均增大,导致CO转化率变小。

【题目】自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。

I.请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙_____;
(2)氯化钠溶液中分离出氯化钠____;
(3)分离植物油和水____;
(4)海水淡化___;
(5)除去自来水中的Cl﹣等杂质____;
(6)从碘水中分离出I2____。
II.碘水中提取碘单质的方法如下:
(1)萃取分液
①下列可作为碘水中提取碘单质萃取剂的是____
A.酒精 B.苯
②分液漏斗在使用前必须先____
③查资料得知:ρ(H2O)>ρ(苯)>ρ(酒精),若用①中所选萃取剂萃取碘水中的碘单质,分液时,上层液体显___色。
(2)蒸馏
①装置A中a的名称是___,a中加入少量___防止加热时液体暴沸。冷凝装置中冷凝水应该____口进(填“上”或“下”)。
②已知碘和四氯化碳的熔沸点数据如表
熔点 | 沸点 | |
碘 | 113.7℃ | 184.3℃ |
四氯化碳 | -22.6℃ | 76.8℃ |
若用蒸馏法分离碘和四氯化碳的混合物,锥形瓶中先收集到的物质的名称是______。
Ⅲ.海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
[海水]![]() [粗盐]
[粗盐]![]() [食盐水]→[氯化钠晶体]
[食盐水]→[氯化钠晶体]
问题一:粗盐中含Ca2+、Mg2+、SO42﹣等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④调节溶液的pH等于7 ⑤溶解 ⑥过滤 ⑦蒸发,正确的操作顺序是____(填选项字母)
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
问题二:蒸发进行到____时,停止加热。
问题三:粗盐中含有少量泥沙、CaCl2、MgCl2及硫酸盐,将粗盐溶解后,先过滤将泥沙除去,再检验滤液中的SO42﹣,如何检验某未知溶液中的SO42﹣___。