��Ŀ����
����Ŀ����2 L�ܱ�������ͨ��a mol����A��b mol����B����һ�������·�����Ӧ��xA(g)��yB(g) ![]() pC(g)��qD(g)����֪��ƽ����Ӧ����vC=
pC(g)��qD(g)����֪��ƽ����Ӧ����vC=![]() vA����Ӧ2 minʱ��A�����ʵ���������
vA����Ӧ2 minʱ��A�����ʵ���������![]() ��B�����ʵ���������
��B�����ʵ���������![]() mol����a mol D���ɡ�
mol����a mol D���ɡ�
�ش��������⣺
��1����Ӧ2 min�ڣ�vA=________��vB=________��
��2����ѧ����ʽ�У�x=________��y=__________��p=__________��q=________��
��3����Ӧƽ��ʱ��DΪ2a mol����B��ת����Ϊ________��
��4�����ֻ���߷�Ӧ�¶ȣ�������Ӧ�������䣬ƽ��ʱDΪ1.5a mol����÷�Ӧ����H________0��(������������������=��)
��5����������������䣬���������ݻ���Ϊ1 L������ͬ����ʵ�飬����������Ӧ�Ƚϣ��ٷ�Ӧ����________(��������������С������������)��������_____________________��
��ƽ��ʱ��Ӧ���ת����________(��������������С������������)��������__________________��
���𰸡�![]() mol��(L��min)1
mol��(L��min)1 ![]() mol��(L��min)1 2 3 1 6
mol��(L��min)1 2 3 1 6 ![]() ��100% �� ���� �����С����Ӧ���Ũ���������ʹ��Ӧ�������� ��С �����С�������ѹǿ����ƽ��������������ٵķ���(���淴Ӧ����)�ƶ������ʹ��Ӧ��ת���ʼ�С
��100% �� ���� �����С����Ӧ���Ũ���������ʹ��Ӧ�������� ��С �����С�������ѹǿ����ƽ��������������ٵķ���(���淴Ӧ����)�ƶ������ʹ��Ӧ��ת���ʼ�С
��������
��1����Ӧ2 min�ڣ�vA=c/t=a/3/(2��2)=![]() mol��(L��min)1 ��vB=c/t= a/2/(2��2)=
mol��(L��min)1 ��vB=c/t= a/2/(2��2)= ![]() mol��(L��min)1������������������ǣ�
mol��(L��min)1������������������ǣ� ![]() mol��(L��min)1 ��
mol��(L��min)1 �� ![]() mol��(L��min)1��
mol��(L��min)1��
(2) �ɣ�1����֪��vA=![]() mol��(L��min)1��vB=
mol��(L��min)1��vB= ![]() mol��(L��min)1��ͬ���ɵ�vD��a/(2��2)mol��L��1��min��1��vC��1/2vA��a/24mol��L��1��min��1���ɻ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ����ʽ�л�ѧ������֮�ȿɵ�x��y��p��q��vA��vB��vC��vD��a/12:a/8:a/24:a/4=2:3:1:6�����Ի�ѧ����ʽ�У�x=2��y=3��p=1��q=6������������������ǣ�2�� 3 ��1 ��6��
mol��(L��min)1��ͬ���ɵ�vD��a/(2��2)mol��L��1��min��1��vC��1/2vA��a/24mol��L��1��min��1���ɻ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ����ʽ�л�ѧ������֮�ȿɵ�x��y��p��q��vA��vB��vC��vD��a/12:a/8:a/24:a/4=2:3:1:6�����Ի�ѧ����ʽ�У�x=2��y=3��p=1��q=6������������������ǣ�2�� 3 ��1 ��6��
��3��2A(g)��3B(g)![]() C(g)��6D(g)��Ӧƽ��ʱ��DΪ2a mol����B��С��a mol�����B��ת����Ϊa/b��100%=a/b��100%��������������������� a/b��100%��
C(g)��6D(g)��Ӧƽ��ʱ��DΪ2a mol����B��С��a mol�����B��ת����Ϊa/b��100%=a/b��100%��������������������� a/b��100%��
(4)������������ֻ�����¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ���������֪ԭƽ��ʱDΪ2amol�������¶ȴﵽ��ƽ��ʱ��DΪ1.5amol���ɼ���Ӧ���淴Ӧ�����ƶ����������Ӧ�Ƿ��ȷ�Ӧ������H<0������������������ǣ�����
(5) ��ԭ�ܱ����������Ϊ2 L���ֱ�Ϊ1 L�������������䣬��Ӧ����������Ũ�ȶ�������˷�Ӧ������������������������ǣ����������С����Ӧ���Ũ���������ʹ��Ӧ��������
�ڼ�С�����Ϊ��ѹ������ѹǿ��ƽ��Ӧ�����������֮��С�ķ����ƶ������ڷ�Ӧ����ʽΪ2A(g)��3B(g)![]() C(g)��6D(g)��������������֮��С�����ƽ�������ƶ�����Ӧ���ת���ʼ�С������������������ǣ���С�������С�������ѹǿ����ƽ��������������ٵķ���(���淴Ӧ����)�ƶ������ʹ��Ӧ��ת���ʼ�С��
C(g)��6D(g)��������������֮��С�����ƽ�������ƶ�����Ӧ���ת���ʼ�С������������������ǣ���С�������С�������ѹǿ����ƽ��������������ٵķ���(���淴Ӧ����)�ƶ������ʹ��Ӧ��ת���ʼ�С��

 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д�����Ŀ��[��ѧ����ѡ��2����ѧ�뼼��]
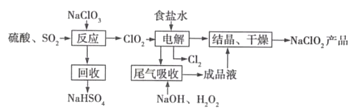
�ۺ���������PFS����˭��������Ҫ������������ͼ���Ի��շ���мΪԭ���Ʊ�PFS��һ�ֹ������̡�

�ش���������
��1������м��ҪΪ���渽�д�������������������Ҫ�ɷ�Ϊ_________�������ɸ��Ŀ����_______
��2�����ʱ����ʵ�����_____��д���������ᷴӦ�����ӷ���ʽ_____________________��
��3����Ӧ���м�����������������_________������������������ʵ���____________�����ţ���
A��KMnO4 | B�� | C�� | D�� |
��4���ۺϸ�����Һ��pH���������һ���ķ�Χ�ڣ�pHƫСʱFe3+ˮ��̶�����pHƫ��ʱ��_______��
��5������ڳ�ѹ��������ѹ�������ŵ���______��
��6���λ���B�Ǻ�������������Ч������Ҫָ�꣬����ʽΪ![]() ��nΪ���ʵ�������Ϊ������Ʒ��Bֵ��ȡ��Ʒmg��ȷ����������ᣬ��ַ�Ӧ���ټ�����к���ȴ������ˮ���Է�̪Ϊָʾ������c
��nΪ���ʵ�������Ϊ������Ʒ��Bֵ��ȡ��Ʒmg��ȷ����������ᣬ��ַ�Ӧ���ټ�����к���ȴ������ˮ���Է�̪Ϊָʾ������c![]() �ı�NaOH��Һ�����к͵ζ������ֲ�����ȥ�����ų������Ӹ��ţ������յ�ʱ����NaOH��ҺV mL�����������������հ������飬����NaOH��Һ
�ı�NaOH��Һ�����к͵ζ������ֲ�����ȥ�����ų������Ӹ��ţ������յ�ʱ����NaOH��ҺV mL�����������������հ������飬����NaOH��Һ![]() ����֪����Ʒ��Fe����������w����B�ı���ʽΪ__________
����֪����Ʒ��Fe����������w����B�ı���ʽΪ__________