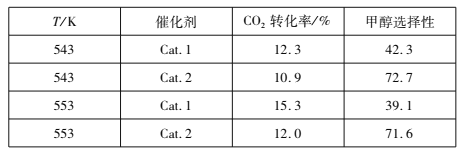
��Ŀ����
����Ŀ����Ȼ���е����ʾ�������Ի�������ʽ���ڣ�Ϊ�˱����о������ã�����Ի������з�����ᴿ������A��B��C��D����ѧ�����Ļ���������ᴿ��װ�á�

I������ݻ���������ᴿ��ԭ�����ش�������ʵ������Ҫʹ������װ�á���A��B��C��D�����ʵ��Ŀո��С�
��1��̼�������Һ�з����̼���_____��
��2���Ȼ�����Һ�з�����Ȼ���____��
��3������ֲ���ͺ�ˮ____��
��4����ˮ����___��
��5����ȥ����ˮ�е�Cl��������____��
��6���ӵ�ˮ�з����I2____��
II����ˮ����ȡ�ⵥ�ʵķ������£�
��1����ȡ��Һ
�����п���Ϊ��ˮ����ȡ�ⵥ����ȡ������____
A���ƾ� B����
�ڷ�Һ©����ʹ��ǰ������____
�۲����ϵ�֪������H2O��>��������>�����ƾ��������â�����ѡ��ȡ����ȡ��ˮ�еĵⵥ�ʣ���Һʱ���ϲ�Һ����___ɫ��
��2������
��װ��A��a��������___��a�м�������___��ֹ����ʱҺ�屩�С�����װ��������ˮӦ��____�ڽ�����������������������
����֪������Ȼ�̼���۷е��������
�۵� | �е� | |
�� | 113.7�� | 184.3�� |
���Ȼ�̼ | -22.6�� | 76.8�� |
���������������Ȼ�̼�Ļ�����ƿ�����ռ��������ʵ�������______��
��ˮ���̲��ŷḻ����Դ����ʵ������ȡ������ˮ�������������̵�ʵ�飺
[��ˮ]![]() [����]
[����]![]() [ʳ��ˮ]��[�Ȼ��ƾ���]
[ʳ��ˮ]��[�Ȼ��ƾ���]
����һ�������к�Ca2+��Mg2+��SO42�������ʣ���Ҫ�ᴿ������ۺ����á������ᴿ�IJ����У�
�ټ��������Na2CO3��Һ �ڼ��������BaCl2��Һ �ۼ��������NaOH��Һ �ܵ�����Һ��pH����7 ���ܽ� ���� ����������ȷ�IJ���˳����____����ѡ����ĸ��
a���ݢڢۢ٢ޢܢ� b���ݢ٢ڢۢޢܢ�
c���ݢڢ٢ۢܢޢ� d���ݢۢڢ٢ޢܢ�
��������������е�____ʱ��ֹͣ���ȡ�
�������������к���������ɳ��CaCl2��MgCl2�������Σ��������ܽ���ȹ��˽���ɳ��ȥ���ټ�����Һ�е�SO42������μ���ijδ֪��Һ�е�SO42��___��
���𰸡�B D C A A C B ��© �Ϻ� ������ƿ ��ʯ�����Ƭ �� ���Ȼ�̼ ad ���������д���������� ȡ��������Һ�ڽྻ���Թ��У������е���������ϡ���ᣬ���������������μӼ����Ȼ�����Һ����������ɫ���������Һ�к������������֮���������
��������
I����ͼ��֪��װ��AΪ����װ�ã�װ��BΪ����װ�ã�װ��CΪ��Һװ�ã�װ��DΪ����װ�ã�
II����1�����ӵ�ˮ����ȡ�ⵥ�ʵ���ȡ��������ˮ���ܡ�������ˮ�͵ⷴӦ��������ȡ���е��ܽ��Զ����ˮ��
�����Һ©����ƿ���ͻ��������Է�Һ©����ʹ��ǰ�����ȼ���Ƿ�©Һ��
�������ܶȱ�ˮС��ѡ�ñ�����ȡ����ȡ��ˮ�еĵⵥ�ʣ��ϲ�Ϊ��ı���Һ��
��2����װ��AΪ����װ�ã�����ʱӦ��������ƿ�м����ʯ�����Ƭ��ֹ���У�Ϊ��ǿ����Ч��������װ��������ˮӦ�ô��¿ڽ���
�������������Ȼ�̼���۷е����ݿ�֪�����Ȼ�̼�ķе�ϵͣ�
��������һ����ȥ�����еĿ��������ʣ�����ѡ�ù�������������Һ��ȥMg2+�������Ȼ�����Һ��ȥSO42��������̼������Һ��ȥCa2+������Ba2+���������������Һ��pH����7��ȥ��������������̼������ӣ�
��������������е����������д����������ʱ��ֹͣ���ȣ������������ɣ�
������������ijδ֪��Һ�е�SO42���ķ������ȼ������ᣬ�ټ����Ȼ�����Һ���۲��Ƿ��а�ɫ�������ɡ�
I����1��̼�������Һ�з����̼���Ӧѡ�ù��˵ķ������ʴ�Ϊ��B��
��2���Ȼ�����Һ�з�����Ȼ���Ӧѡ�������ķ������ʴ�Ϊ��D��
��3������ֲ���ͺ�ˮӦѡ�÷�Һ�ķ������ʴ�Ϊ��C��
��4����ˮ����Ӧѡ������ķ������ʴ�Ϊ��A��
��5����ȥ����ˮ�е�Cl��������Ӧѡ������ķ������ʴ�Ϊ��A��
��6���ӵ�ˮ�з����I2Ӧѡ����ȡ��Һ�ķ������ʴ�Ϊ��C��
II����1�����ӵ�ˮ����ȡ�ⵥ�ʵ���ȡ��������ˮ���ܣ��ƾ��ܺ�ˮ������������ܣ���������ˮ����ѡB���ʴ�Ϊ��B��
�����Һ©����ƿ���ͻ��������Է�Һ©����ʹ��ǰ�����ȼ���Ƿ�©Һ���ʴ�Ϊ����©��
�������ܶȱ�ˮС��ѡ�ñ�����ȡ����ȡ��ˮ�еĵⵥ�ʣ��ϲ�Ϊ��ɫ���Ϻ�ɫ��ı���Һ���ʴ�Ϊ���Ϻ�ɫ��
��2����װ��AΪ����װ�ã�����a������Ϊ������ƿ��Ϊ��ֹ����ʱҺ�屩�У�Ӧ��������ƿ�м����ʯ�����Ƭ��ֹ���У�Ϊ��ǿ����Ч��������װ��������ˮӦ�ô��¿ڽ����ʴ�Ϊ��������ƿ����ʯ�����Ƭ���£�
�������������Ȼ�̼���۷е����ݿ�֪�����Ȼ�̼�ķе�ϵͣ����������������Ȼ�̼�Ļ�����ƿ�����ռ���������Ϊ���Ȼ�̼���ʴ�Ϊ�����Ȼ�̼��
��������һ����ȥ�����к�Ca2+��Mg2+��SO42��������ʱ��Ӧ�Ƚ������ܽ������Һ������Һ�м����������������Һ��ȥMg2+����������Ȼ�����Һ��ȥSO42���������������������Һ���Ȼ�����Һ��˳����Ե������ټ������̼������Һ��ȥCa2+������Ba2+�����ˣ�����Һ�м������������Һ��pH����7��ȥ��������������̼������ӣ��������������Һ�õ��Ȼ��ƾ��壬��ȷ�IJ���˳�����ݢڢۢ٢ޢܢ����ݢۢڢ٢ޢܢ����ʴ�Ϊ��ad��
��������������е����������д����������ʱ��ֹͣ���ȣ������������ɣ��ʴ�Ϊ�����������д���������֣�
������������ijδ֪��Һ�е�SO42���ķ�����ȡ��������Һ�ڽྻ���Թ��У������е���������ϡ���ᣬ�������������μӼ����Ȼ�����Һ���۲��Ƿ������ɫ�������ʴ�Ϊ��ȡ��������Һ�ڽྻ���Թ��У������е���������ϡ���ᣬ�������������μӼ����Ȼ�����Һ����������ɫ���������Һ�к������������֮���������

����Ŀ��[��ѧ����ѡ��2����ѧ�뼼��]
�ۺ���������PFS����˭��������Ҫ������������ͼ���Ի��շ���мΪԭ���Ʊ�PFS��һ�ֹ������̡�

�ش���������
��1������м��ҪΪ���渽�д�������������������Ҫ�ɷ�Ϊ_________�������ɸ��Ŀ����_______
��2�����ʱ����ʵ�����_____��д���������ᷴӦ�����ӷ���ʽ_____________________��
��3����Ӧ���м�����������������_________������������������ʵ���____________�����ţ���
A��KMnO4 | B�� | C�� | D�� |
��4���ۺϸ�����Һ��pH���������һ���ķ�Χ�ڣ�pHƫСʱFe3+ˮ��̶�����pHƫ��ʱ��_______��
��5������ڳ�ѹ��������ѹ�������ŵ���______��
��6���λ���B�Ǻ�������������Ч������Ҫָ�꣬����ʽΪ![]() ��nΪ���ʵ�������Ϊ������Ʒ��Bֵ��ȡ��Ʒmg��ȷ����������ᣬ��ַ�Ӧ���ټ�����к���ȴ������ˮ���Է�̪Ϊָʾ������c
��nΪ���ʵ�������Ϊ������Ʒ��Bֵ��ȡ��Ʒmg��ȷ����������ᣬ��ַ�Ӧ���ټ�����к���ȴ������ˮ���Է�̪Ϊָʾ������c![]() �ı�NaOH��Һ�����к͵ζ������ֲ�����ȥ�����ų������Ӹ��ţ������յ�ʱ����NaOH��ҺV mL�����������������հ������飬����NaOH��Һ
�ı�NaOH��Һ�����к͵ζ������ֲ�����ȥ�����ų������Ӹ��ţ������յ�ʱ����NaOH��ҺV mL�����������������հ������飬����NaOH��Һ![]() ����֪����Ʒ��Fe����������w����B�ı���ʽΪ__________
����֪����Ʒ��Fe����������w����B�ı���ʽΪ__________