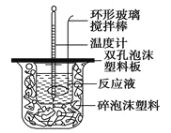
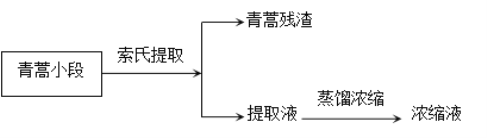
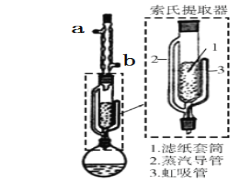
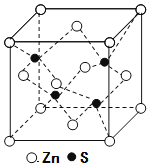
题目内容
【题目】下列说法中正确的是![]()
![]()
A.盐酸的导电能力一定比醋酸的导电能力强
B.一定量的锌粒与足量稀硫酸反应,向反应混合液中加入醋酸钠固体,产生![]() 速率减小,
速率减小,![]() 体积减小
体积减小
C.相同温度下![]() 氨水
氨水![]() 的浓度比
的浓度比![]() 溶液
溶液![]() 的浓度小
的浓度小
D.![]() 氨水可以使酚酞试液变红,证明
氨水可以使酚酞试液变红,证明![]() 是弱碱
是弱碱
【答案】C
【解析】
A.导电性与离子浓度和离子所带电荷有关,与电解质的强弱无关,而等浓度时盐酸溶液的导电能力比醋酸溶液的导电能力强,故A错误;
B.加入![]() 固体,结合生成醋酸,减小了
固体,结合生成醋酸,减小了![]() 的浓度,锌粒的物质的量不变,则
的浓度,锌粒的物质的量不变,则![]() 减小,生成
减小,生成![]() 体积不变,故B错误;
体积不变,故B错误;
C.![]() 是强电解质、一水合氨是弱电解质,相同温度下,
是强电解质、一水合氨是弱电解质,相同温度下,![]() 溶液中水解剩下的
溶液中水解剩下的![]() 的浓度比
的浓度比![]() 氨水中电离产生的
氨水中电离产生的![]() 的浓度大得多,故C正确;
的浓度大得多,故C正确;
D.![]()
![]() 氨水可以使酚酞试液变红,只能说明氨水呈碱性,但不能证明
氨水可以使酚酞试液变红,只能说明氨水呈碱性,但不能证明![]() 是否完全电离,故D错误。
是否完全电离,故D错误。
故选C。

练习册系列答案
相关题目
【题目】溶液X中含有右表离子中的某5种,且其浓度均为![]() 不考虑水的电离与离子水解
不考虑水的电离与离子水解![]() 向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
阳离子 | 阴离子 |
Fe Fe |
|
A.X溶液中不可能含有![]() 或
或![]()
B.生成无色气体的离子方程式为:![]()
C.根据电荷守恒,原溶液中一定含![]()
D.X溶液中一定含3种阳离子、2种阴离子