题目内容
【题目】溴化亚铜(CuBr)常用作有机合成原料和反应催化剂等,它是一种不溶于水的白色结晶粉末,受热或见光易分解,接触空气会被缓慢氧化成绿色粉末。制备CuBr的实验步骤如下:
步骤1:在如图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO22小时。
步骤2:溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3:依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤。
步骤4:将获得的产品经系列干燥剂干燥后,再进行真空干燥。

请根据上述制备步骤回答有关问题:
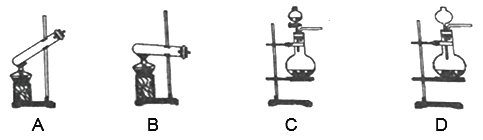
(1)制备中用到的SO2在实验室中通常是用浓硫酸和亚硫酸钠为原料来制备的,在制备SO2时装置可以选择下图中的____________(填装置编号),发生反应的化学方程式为____________。
(2)步骤1中:①所用蒸馏水需提前煮沸处理,这样做的目的是____________。
②为控制反应在60℃进行可采取的措施是________________。
③三颈烧瓶中反应生成CuBr的离子方程式为_____________。
④判断反应已经完成的现象是______________。
(3)步骤2在过滤时需要避光的原因是___________。
(4)步骤3中用到的洗涤剂水、乙醇中均“溶有少量SO2”的原因是____________。
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。需用到以下试剂:SO2(贮存在钢瓶中)、100g20%NaOH溶液、乙醇等。请将下列实验步骤补充完整。
①向烧杯中继续通入SO2至溶液饱和;②____________;③加入少量维生素C溶液(抗氧化剂),蒸发浓缩,冷却结晶;④______________;⑤放真空干燥箱中干燥。
【答案】 C H2SO4+Na2SO3═Na2SO4+H2O+SO2↑ 除去水中的O2 60℃水浴加热 2Cu2++2Br-+SO2+2H2O═2CuBr↓+SO42-+4H+ 溶液蓝色完全褪去 防止CuBr见光分解 防止CuBr被氧化 然后向烧杯中加入100g20%NaOH溶液 过滤,然后用乙醇洗涤产品2—3次
【解析】(1)制备SO2用固体与液体不加热,故选C装置;反应为 H2SO4+Na2SO3═Na2SO4+H2O+SO2↑;(2),步骤1中:①CuBr接触空气会被缓慢氧化成绿色粉末,所用蒸馏水需提前煮沸处理,这样做的目的是除去水中的O2,防止氧化CuBr;②控制反应在100℃以下常用水浴加热,为控制反应在60℃进行可采取的措施是60℃水浴加热;③SO2作还原剂,三颈烧瓶中反应生成CuBr的离子方程式为2Cu2++2Br-+SO2+2H2O═2CuBr↓+SO42-+4H+ ;④Cu2+ 溶液呈蓝色,判断反应已经完成的现象是溶液蓝色完全褪去;(3)溴化亚铜(CuBr)常用作有机合成原料和反应催化剂等,它是一种不溶于水的白色结晶粉末,受热或见光易分解,步骤2在过滤时需要避光的原因是防止CuBr见光分解;(4)步骤3中用到的洗涤剂水、乙醇中均“溶有少量SO2”的原因是保持还原性条件,防止CuBr被氧化;(5)吸收液主要含Na2SO3、NaHSO3,向烧杯中继续通入SO2至溶液饱和,将Na2SO3转化为NaHSO3,根据钠守恒,溶液中NaHSO3为0.5mol,②然后向烧杯中加入100g20%NaOH溶液,将NaHSO3再转化为Na2SO3,加入少量维生素C溶液(抗氧化剂),蒸发浓缩,冷却结晶;过滤,然后用乙醇洗涤产品2—3次,除去表面的杂质,放真空干燥箱中干燥。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案