题目内容
16.下表给出了六种元素的相关信息,其中A、B、C、D、E为短周期元素.| 元素 | 相 关 信 息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三种必需元素之一,它能形成多种氧化物,其氢化物是中学化学里学习的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝. |
| D | 室温下其单质呈淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它在空气剧烈燃烧,有黄色火焰,生成的淡黄色固态化合物可用于潜水艇的供氧剂. |
| F | 它是人体不可缺少的微量元素,其单质也是应用最广的金属原材料,常用于制造桥梁、轨道等. |
(1)A元素符号H F元素的名称铁
(2)C元素在周期表中的位置第2周期VA族
(3)D元素原子结构示意图
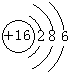
(4)E元素最高价氧化物对应水化物化学式为NaOH
(5)有A、B和E三种元素组成的化合物属于离子晶体(填“原子”、“离子”或“分子”),其晶体中含有的化学键类型为离子键、共价键.
(6)B和D对应的气态氢化物中,热稳定性较强的是H2O,熔沸点较高的是H2O.(用具体的化学式表示)
(7)D的最高价含氧酸稀溶液与F单质反应的离子方程式Fe+2H+=Fe2++H2↑.
分析 A、B、C、D为短周期元素,氢气的燃烧产物为水,是倍受青睐的清洁燃料,则A为H;分离液态空气可得到氮气和氧气,臭氧能保护地球地表环境,则B为O;C是植物生长三种必需元素之一,它能形成多种氧化物,它能形成多种氧化物,其氢化物是中学化学里学习的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,则C为N;室温下D的单质呈粉末状固体,加热易熔化,该单质在氧气中燃烧,发出明亮的蓝紫色火焰,则D为S;E在空气剧烈燃烧,有黄色火焰,生成的淡黄色固态化合物可用于潜水艇的供氧剂,则E为Na;由F为人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等,则F为Fe,然后利用元素及其单质、化合物的性质来解答.
解答 解:A、B、C、D为短周期元素,氢气的燃烧产物为水,是倍受青睐的清洁燃料,则A为H;分离液态空气可得到氮气和氧气,臭氧能保护地球地表环境,则B为O;C是植物生长三种必需元素之一,它能形成多种氧化物,它能形成多种氧化物,其氢化物是中学化学里学习的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,则C为N;室温下D的单质呈粉末状固体,加热易熔化,该单质在氧气中燃烧,发出明亮的蓝紫色火焰,则D为S;E在空气剧烈燃烧,有黄色火焰,生成的淡黄色固态化合物可用于潜水艇的供氧剂,则E为Na;由F为人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等,则F为Fe.
(1)A元素符号为H,F元素的名称为铁,故答案为:H;铁;
(2)C为N元素,在周期表中的位置:第2周期VA族,故答案为:第2周期VA族;
(3)D为S元素,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(4)E为Na元素,最高价氧化物对应水化物化学式为NaOH,故答案为:NaOH;
(5)有A、B和E三种元素组成的化合物为NaOH,属于离子化合物,含有离子键、共价键,故答案为:离子;离子键、共价键;
(6)B和D对应的氢化物分别为H2O、H2S,由于非金属性O>S,故稳定性:H2O>H2S,由于水分子之间存在氢键,故沸点H2O>H2S,故答案为:H2O;H2O;
(7)D的最高价含氧酸为硫酸,稀硫酸溶液与Fe单质反应的离子方程式为:Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑.
点评 本题考查结构性质位置关系应用,熟悉元素及物质的性质是解答本题的关键,难度不大.

| 选项 | 化学反应 | 能量转化形式 |
| A | CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | 化学能转化成热能 |
| B | Pb+PbO2+2H2SO4 $?_{放电}^{充电}$2PbSO4+2H2O | 使用时放电,电能转化成化学能 |
| C | mH2O+nCO2 $→_{叶绿体}^{光}$Cn(H2O)m+O2 | 光能转化成化学能 |
| D | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | 热能转化成化学能 |
| A. | A | B. | B | C. | C | D. | D |
| A. | CO2+CH4$→_{△}^{催化剂}$CH3COOH | |
| B. | 2CO2+6H2$→_{△}^{催化剂}$C2H5OH十3H2O | |
| C. | 2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O | |
| D. | 6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2 |
| A. | 同一种核素 | B. | 互为同分异构体 | C. | 互为同素异形体 | D. | 互为同位素 |
| A. | 用醋酸去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 氯化铝与足量氨水反应:Al3++3NH3•H2O═3NH4++Al(OH)3↓ | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 稀硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
 ,(CH3)3COH的名称2-甲基-2-丙醇(系统命名法)
,(CH3)3COH的名称2-甲基-2-丙醇(系统命名法)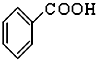 ⑤CH3CHO ⑥
⑤CH3CHO ⑥
 和
和  ⑥
⑥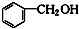 和
和 ⑦CH3CH2NO2和
⑦CH3CH2NO2和
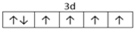 ,
,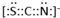 .F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为12×6.02×1023个或12NA
.F常作为配合物的中心离子,1mol F(BC)63-中含有σ键的数目为12×6.02×1023个或12NA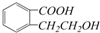 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: C.
C. D.
D. E.
E.
 .
.