题目内容
4.将CO2转化成有机物可有效地实现碳循环.原子利用率为目标产物的总质量与全部反应物的总质量之比,则以下反应中理论上原子利用率最高的是( )| A. | CO2+CH4$→_{△}^{催化剂}$CH3COOH | |
| B. | 2CO2+6H2$→_{△}^{催化剂}$C2H5OH十3H2O | |
| C. | 2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O | |
| D. | 6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2 |
分析 反应物全部转化为生成物,没有其他物质生成的反应中的原子利用率最高,据此解答.
解答 解:A.CO2和CH4反应全部转化为剂CH3COOH,反应物全部转化为产物,原子利用率100%,故A选;
B.二氧化碳与氢气反应生成甲醇外还生成副产物水,故B不选;
C.CO2和H2反应生成乙烯之外还有水的生成,故C不选;
D.CO2转化为C6H12O6之外还有氧气产生,故D不选;
故选A.
点评 本题考查了原子的经济利用率,熟悉原子经济利用率的概念是解题关键,注意从生成物的种类判断.

练习册系列答案
相关题目
14.下列实验方案正确且能达到相应实验预期目的是( )
| A. |  分离碘酒中的碘和酒精 | B. | 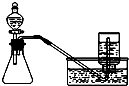 用铜和浓硝酸制取少量NO2 | ||
| C. | 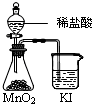 比较MnO2、Cl2、I2的氧化性 | D. | 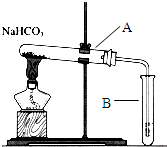 探究NaHCO3的热稳定性 |
15.由CH2=CH2制备HO-CH2-CH2-OH,所发生的化学反应是( )
| A. | 加成反应 | B. | 消去反应、氧化反应 | ||
| C. | 氧化反应、加成反应 | D. | 加成反应、取代反应 |
19.下列物质中,与水反应剧烈程度最强的是( )
| A. | Li | B. | Na | C. | K | D. | Cs |
16.下表给出了六种元素的相关信息,其中A、B、C、D、E为短周期元素.
请根据以上信息回答问题:
(1)A元素符号H F元素的名称铁
(2)C元素在周期表中的位置第2周期VA族
(3)D元素原子结构示意图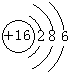
(4)E元素最高价氧化物对应水化物化学式为NaOH
(5)有A、B和E三种元素组成的化合物属于离子晶体(填“原子”、“离子”或“分子”),其晶体中含有的化学键类型为离子键、共价键.
(6)B和D对应的气态氢化物中,热稳定性较强的是H2O,熔沸点较高的是H2O.(用具体的化学式表示)
(7)D的最高价含氧酸稀溶液与F单质反应的离子方程式Fe+2H+=Fe2++H2↑.
| 元素 | 相 关 信 息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三种必需元素之一,它能形成多种氧化物,其氢化物是中学化学里学习的唯一的碱性气体,能使湿润的红色石蕊试纸变蓝. |
| D | 室温下其单质呈淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它在空气剧烈燃烧,有黄色火焰,生成的淡黄色固态化合物可用于潜水艇的供氧剂. |
| F | 它是人体不可缺少的微量元素,其单质也是应用最广的金属原材料,常用于制造桥梁、轨道等. |
(1)A元素符号H F元素的名称铁
(2)C元素在周期表中的位置第2周期VA族
(3)D元素原子结构示意图

(4)E元素最高价氧化物对应水化物化学式为NaOH
(5)有A、B和E三种元素组成的化合物属于离子晶体(填“原子”、“离子”或“分子”),其晶体中含有的化学键类型为离子键、共价键.
(6)B和D对应的气态氢化物中,热稳定性较强的是H2O,熔沸点较高的是H2O.(用具体的化学式表示)
(7)D的最高价含氧酸稀溶液与F单质反应的离子方程式Fe+2H+=Fe2++H2↑.
13.下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 12 g石墨中含有C-C键的个数为1.5NA | |
| C. | 12 g金刚石中含有C-C键的个数为4NA | |
| D. | SiO2晶体中存在四面体结构单元,O处于中心,Si处于4个顶角 |
14.自然界中,锰的主要矿石有软锰矿(主要成分Mn02)和菱锰矿(主要成分MnCO3 )金属锰的提炼方式主要有火法和湿法两种.请回答下列问题:
(1)火法炼锰可用铝与软锰矿高温反应进行.该反应的化学方程式是4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn.
湿法炼锰有电解硫酸锰溶液法.电解锰的生产过程分为化合浸取、氧化净化、沉淀除杂及产品回收.其生产工艺流程如图:
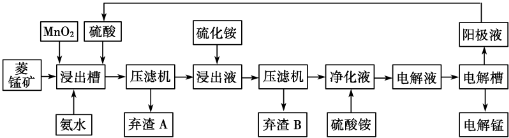
已知:①菱锰矿中主要杂质是Fe2+、Co2+、Ni2+
②生成氢氧化物的pH如下表:
③有关难溶氢氧化物和硫化物pKsp数据(pKsp=-1gKsp)
(2)菱锰矿粉与硫酸反应的化学方程式是MnCO3+H2SO4═MnSO4+H2O+CO2↑
(3)Mn02的作用是除去菱锰矿的硫酸浸取液中的Fe2+,该除杂过程的离子方程式是MnO2+2 Fe2++4H+═2 Fe3++Mn2++2H2O
(4)使用氨水的目的是调整pH到2.7-7.6之间(填pH范围,精确到小数点后1位数字).在“浸出液”中加入硫化按的目的是作沉淀剂,生成NiS、CoS沉淀
(5)电解槽中使用的是惰性电极板,电解反应方程式为2MnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+O2↑+2Mn.
(1)火法炼锰可用铝与软锰矿高温反应进行.该反应的化学方程式是4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn.
湿法炼锰有电解硫酸锰溶液法.电解锰的生产过程分为化合浸取、氧化净化、沉淀除杂及产品回收.其生产工艺流程如图:

已知:①菱锰矿中主要杂质是Fe2+、Co2+、Ni2+
②生成氢氧化物的pH如下表:
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
| 难容物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(3)Mn02的作用是除去菱锰矿的硫酸浸取液中的Fe2+,该除杂过程的离子方程式是MnO2+2 Fe2++4H+═2 Fe3++Mn2++2H2O
(4)使用氨水的目的是调整pH到2.7-7.6之间(填pH范围,精确到小数点后1位数字).在“浸出液”中加入硫化按的目的是作沉淀剂,生成NiS、CoS沉淀
(5)电解槽中使用的是惰性电极板,电解反应方程式为2MnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+O2↑+2Mn.
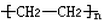 .
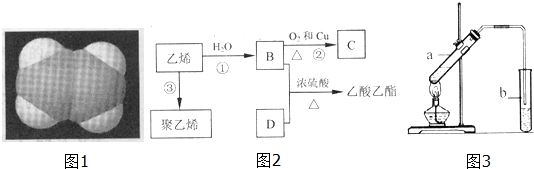
.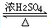 CH3COOC2H5+H2O,反应类型是酯化或取代反应.
CH3COOC2H5+H2O,反应类型是酯化或取代反应.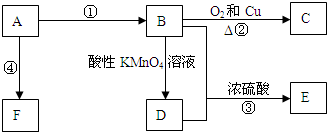
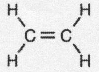 .
.
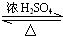 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.