题目内容
设法把NO2和O2按4:1体积比充满一干燥的真空烧瓶中,然后把烧瓶置于水中,瓶内液面会逐渐上升,则最终烧瓶中所得溶液的物质的量浓度为(①气体体积为标准状况下测定 ②烧瓶中溶液不向外扩散)( )
| A.1/14mol/L | B.1/22.4mol/L | C.1/28mol/L | D.1/42mol/L |
C
解析试题分析:因为4NO2+O2+2H2O=4HNO3 。可以假设烧瓶的体积为1L,则其中的NO2的体积为4/5L。所以可以求出溶质硝酸的物质的量=4/5*(1/22.4)mol。又因为反应后没有剩余的气体。则溶液的体积为1L。利用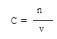 求解可得到4/5*(1/22.4) mol/L,化简为1/28mol/L
求解可得到4/5*(1/22.4) mol/L,化简为1/28mol/L
考点:要求学生掌握气体溶于水的浓度计算包含:与水反应后剩余气体的体积计算,气体溶于水后的浓度计算。

练习册系列答案
相关题目
有AlCl3和NaCl的混合溶液VL,将它均分成两份。一份滴加氨水,使Al3+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗a mol NH3·H2O、b mol AgNO3。据此得知原混合溶液中的c(Na+) (mol/L)为
| A.(2b-4a)/V | B.(b-a)/V | C.(2b-2a)/V | D.(b-2a)/V |
下列叙述正确的是( )
| A.0.012 kg12C含有6.02×1023个碳原子 | B.1mol任何物质都含有6.02×1023个原子 |
| C.硫酸的摩尔质量是98g | D.常温常压下,1 mol氧气的体积为22.4L |
设阿伏加德常数为NA,则下列说法正确的是( )
| A.常温常压下,11.2 LCH4中含有的氢原子数为2NA |
| B.标准状况下,22.4 L二氧化硫中含有氧原子数为NA |
| C.2.7 g铝与足量的盐酸反应,失去的电子数为0.3NA |
| D.1 L 0.1 mol/L MgCl2溶液中含Cl-数为0.1NA |
下列电子式书写正确的是
A. | B. | C. | D.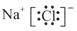 |
用NA代表阿伏加德罗常数。下列说法正确的是( )
| A.9 g中所含质子数为0.5×6.02×1023 |
| B.电解精炼铜时,每转移l mol电子,阳极上溶解的金属必为32g |
| C.往存在V2O5的密闭容器中加入2molSO2和lmolO2,充分反应后分子总数等于2NA |
| D.V L a mol·L–1的氯化铁溶液中,若Fe3+的数目为NA,则Cl–的数目大于3NA |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温常压下,17g羟基中含有的电子数目为10NA |
| B.常温常压下,28g由C2H4和C3H6组成的混合气体中含有的碳原子数目为2NA |
| C.0.05mol熔融的NaHSO4中含有的离子数目为0.15NA |
| D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
下列有关化学用语表示正确的是
A.中子数为18的硫原子: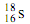 |
B.COCl2的电子式: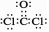 |
C.Al3+的结构示意图: |
D.聚丙烯的结构简式: |
下列化学(或离子)方程式正确的是
A.乙酸与碳酸钠溶液反应:2H++CO =CO2↑+H2O =CO2↑+H2O |
B.C6H6+HNO3 C6H5NO2+H2O C6H5NO2+H2O |
C.亚硫酸的电离方程式:H2SO3 2H++SO32- 2H++SO32- |
| D.醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→ CH3COO-+H2O |