题目内容
用NA代表阿伏加德罗常数。下列说法正确的是( )
| A.9 g中所含质子数为0.5×6.02×1023 |
| B.电解精炼铜时,每转移l mol电子,阳极上溶解的金属必为32g |
| C.往存在V2O5的密闭容器中加入2molSO2和lmolO2,充分反应后分子总数等于2NA |
| D.V L a mol·L–1的氯化铁溶液中,若Fe3+的数目为NA,则Cl–的数目大于3NA |
D
解析试题分析:A、重水(D2O)的摩尔质量为20g·mol–1,9g重水(D2O)的物质的量为0.45mol,每摩尔重水(D2O)含10mol质子,所以9g重水(D2O)所含质子数为0.45×10×6.02×1023,错误;B、电解精炼铜时,阳极为粗铜,阳极发生的主要反应为:Cu-2e-=Cu2+,还会发生Fe-2e-=Fe2+、Zn-2e-=Zn2+、Ni-2e-=Ni2+等反应,并不只有铜失电子,所以每转移1mol电子时,阳极上溶解的金属不一定为32g,错误;C、在密闭中SO2的催化氧化是可逆反应,2molSO2和lmolO2不能完全转化为2molSO3,因此反应后分子总数大于2NA,错误;D、FeCl3电离时产生的Fe3+水解,造成Fe3+的数目与Cl–的数目比小于1﹕3,正确。
考点:考查阿伏加德罗常数的应用;微粒数的计算、铜的精炼、可逆反应特征及铁盐水解。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
用NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A.7.1 g Cl2与足量NaOH溶液反应,转移的电子数为0.1 NA |
| B.在常温常压下,5.6 L CO中含有的原子数为0.5NA |
| C.4g NaOH固体中含有的离子总数为0.3 NA |
| D.13.5 g Al与足量盐酸反应生成H2的分子数为NA |
以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的( )
| A.现有CO、CO2、O3三种气体,它们分别都含有1molO,则三种气体的物质的量之比为 3∶2∶1 |
| B.5.6g CO 和22.4L CO2中含有的碳原子数一定相等 |
| C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32 |
| D.n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为 35.5m/n |
下列生活中的现象,不涉及化学变化的是( )
| A.用糯米酿酒 | B.用干冰进行人工降雨 |
| C.用过氧乙酸杀菌消毒 | D.绿色植物的光合作用 |
设法把NO2和O2按4:1体积比充满一干燥的真空烧瓶中,然后把烧瓶置于水中,瓶内液面会逐渐上升,则最终烧瓶中所得溶液的物质的量浓度为(①气体体积为标准状况下测定 ②烧瓶中溶液不向外扩散)( )
| A.1/14mol/L | B.1/22.4mol/L | C.1/28mol/L | D.1/42mol/L |
下列叙述正确确的是( )
A.48gO3和O2的混合气体中含有6.02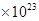 个分子 个分子 |
B.常温常压下,4.6gNO2气体含有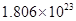 个原子 个原子 |
C.0.5mol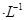 1LCuCl2溶液中含有 1LCuCl2溶液中含有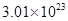 个Cu2+ 个Cu2+ |
D.标准状况下,3.36LH2O含有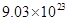 个分子H2O 个分子H2O |
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此判断下列说法错误的是
| A.该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管. |
| B.取10 mL该硫酸于烧杯中,再加18. 4 mL的水可配得49%的硫酸 |
| C.配制200 mL 4. 6 mol/L的稀硫酸需取该硫酸50 mL‘ |
| D.该硫酸与等质量的水混合所得溶液的物质的量浓度小于9. 2 mol/L |
NA为阿伏加德罗常数,下列叙述错误的是( )
| A.46 g NO2和N2O4混合气体中含有原子总数为3NA |
| B.常温下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应小于 0.1NA |
| C.12 g金刚石中含有的共价键数为2NA |
| D.2.1 g DTO中所含中子数为NA |