题目内容
下列化学(或离子)方程式正确的是
A.乙酸与碳酸钠溶液反应:2H++CO =CO2↑+H2O =CO2↑+H2O |
B.C6H6+HNO3 C6H5NO2+H2O C6H5NO2+H2O |
C.亚硫酸的电离方程式:H2SO3 2H++SO32- 2H++SO32- |
| D.醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→ CH3COO-+H2O |
B
解析试题分析:A、乙酸是弱电解质,应该用化学式表示,A不正确,正确的是2CH3COH+CO32-=2CH3COO-+H2O+CO2↑;B、苯与浓硝酸、浓硫酸在加热的条件下发生硝化反应生成硝基苯和水,B正确;C、亚硫酸是二元弱酸,电离是分步进行的,则电离方程式为H2SO3 HSO3-+H+、HSO3-
HSO3-+H+、HSO3- SO32-+H+,C不正确;D、氢氧化铜是难溶性物质,应该用化学式表示,离子方程式为2CH3COOH+Cu(OH)2=2CH3COO-+Cu2++2H2O,D不正确,答案选B。
SO32-+H+,C不正确;D、氢氧化铜是难溶性物质,应该用化学式表示,离子方程式为2CH3COOH+Cu(OH)2=2CH3COO-+Cu2++2H2O,D不正确,答案选B。
考点:考查方程式的正误判断

设法把NO2和O2按4:1体积比充满一干燥的真空烧瓶中,然后把烧瓶置于水中,瓶内液面会逐渐上升,则最终烧瓶中所得溶液的物质的量浓度为(①气体体积为标准状况下测定 ②烧瓶中溶液不向外扩散)( )
| A.1/14mol/L | B.1/22.4mol/L | C.1/28mol/L | D.1/42mol/L |
将23g Na和24g Mg分别投入等质量的过量的盐酸中,反应完毕后,所得溶液的质量分数分别为m和n,则m和n的关系是
| A.m>n | B.m=n | C.m<n | D.无法确定 |
某氯原子的质量为a g , C-12原子的质量为b g,用NA表示阿伏加德罗常数,下列说法中不正确的是
A.则该氯原子构成氯分子的相对分子质量为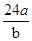 |
| B.1mol该氯原子的质量为aNAg |
C.mg该氯原子的物质的量为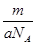 mol mol |
D.ng该氯原子所含的电子数为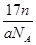 |
今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4 mol·L-1的FeCl3溶液(其它用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变):
| 组别 | ① | ② | ③ | ④ |
| V[FeCl3(aq)]/mL | 100 | 100 | 100 | 100 |
| 混合粉末质量/g | 6 | 13.2 | 24 | 36 |
| 反应后剩余固体质量/g | 0 | 1.28 | 12.8 | 24.8 |
下列结论正确的是( )
A.第①组反应后溶液中c(Fe3+) =" 3.0" mol·L-1
B.第②组剩余固体是铜铁混合物
C.第④组反应后的滤液中c(Fe2+) =" 6" mol·L-1
D.原混合粉末中n(Fe)∶n(Cu) = 3∶2
NA为阿伏加德罗常数,下列叙述错误的是( )
| A.46 g NO2和N2O4混合气体中含有原子总数为3NA |
| B.常温下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应小于 0.1NA |
| C.12 g金刚石中含有的共价键数为2NA |
| D.2.1 g DTO中所含中子数为NA |
以色列科学家Daniel Shechtman因发现准晶体获得2011年诺贝尔化学奖。人们在自然界中也找到了组成为Al63Cu24Fe13的天然准晶体。将相同质量的此准晶体分别与足量的盐酸、烧碱和稀硝酸反应,产生气体的物质的量关系为
| A.n(烧碱)<n(稀硝酸)<n(盐酸) |
| B.n(烧碱)<n(盐酸)<n(稀硝酸) |
| C.n(稀硝酸)<n(烧碱)<n(盐酸) |
| D.n(盐酸)<n(稀硝酸)<n(烧碱) |
在一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物,则该气体化合物的化学式为
| A.X2Y3 | B.XY3 | C.XY | D.X3Y |
20g由两种金属粉末组成的混合物,与足量的盐酸充分反应后得到11.2L氢气(标准状况),这种金属混合物的组成可能是
| A.Mg和Al | B.Al和Fe |
| C.Fe和Zn | D.Zn和Cu |