题目内容
(14分)I、某温度时,在一个2L的密闭容器中, X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为
(2)反应开始至2min,气体Z的平均反应速率为
(3)若X、Y、Z均为气体,反应达平衡时,此时容器内的压强与起始压强之比为
II、一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
注:催化效果用单位时间内每克催化剂得到产品的质量来表示。
(1)表中ω= 。
(2)从实验1、2可以得出的结论是 。
(3)设计实验2、3的目的是 。
III、现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池________________________
(2)如果不能,说明其原因__________________________
(3)如果可以,则写出正、负极材料、电解质溶液名称______ ____。

(1)该反应的化学方程式为
(2)反应开始至2min,气体Z的平均反应速率为
(3)若X、Y、Z均为气体,反应达平衡时,此时容器内的压强与起始压强之比为
II、一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
| 实验序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式/ | 催化效果/g·g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
| 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 | ω | 100 | 振动球磨 | |
(1)表中ω= 。
(2)从实验1、2可以得出的结论是 。
(3)设计实验2、3的目的是 。
III、现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池________________________
(2)如果不能,说明其原因__________________________
(3)如果可以,则写出正、负极材料、电解质溶液名称______ ____。
I、(4分)⑴. 3X + Y  2Z ⑵ 0.05mol.(L.min)-1 ⑶ 9:10
2Z ⑵ 0.05mol.(L.min)-1 ⑶ 9:10
II、(3分)(1)74.45 (2)氯化镁固体含水量越高,催化剂催化效果越差
(3)探究粉碎方式对催化剂催化效果的影响
III、(7分)(1)(A)不能,(B)可以(各1分)
(2)(A)的反应非氧化还原反应,没有电子转移(2分)
(3)负极:铜, 正极:碳棒,电解质溶液:氯化铁溶液(各1分)
 2Z ⑵ 0.05mol.(L.min)-1 ⑶ 9:10
2Z ⑵ 0.05mol.(L.min)-1 ⑶ 9:10II、(3分)(1)74.45 (2)氯化镁固体含水量越高,催化剂催化效果越差
(3)探究粉碎方式对催化剂催化效果的影响
III、(7分)(1)(A)不能,(B)可以(各1分)
(2)(A)的反应非氧化还原反应,没有电子转移(2分)
(3)负极:铜, 正极:碳棒,电解质溶液:氯化铁溶液(各1分)
I、(1)根据图像可知,平衡时XY分别减少了0.3mol、0.1mol,而Z增加了0.2mol。因为变化量之比是相应的化学计量数之比,所以方程式为3X + Y  2Z。
2Z。
(2)Z的反应速率是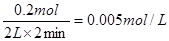
(3)压强之比是气体的物质的量之比,所以容器内的压强与起始压强之比为(0.9+0.7+0.2)︰2=9:10。
II、(1)实验34是探究温度对反应速率的影响的,所以其它条件应该是相同的,及氯元素的含量应该是74.5%。
(2)根据表中数据对比可知,氯化镁固体含水量越高,催化剂催化效果越差。
(3)根据实验2、3中变化量可知,设计实验2、3的目的是探究粉碎方式对催化剂催化效果的影响的。
III、原电池中必需有电流通过,所以只有氧化还原反应才能设计成原电池,A不是氧化还原反应,不能设计成原电池,B是氧化还原反应,可以设计成原电池。根据方程式可知,铜失去电子,铁离子得到电子,所以铜是负极,正极可以是石墨。电解质是氯化铁溶液。
 2Z。
2Z。(2)Z的反应速率是
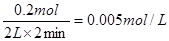
(3)压强之比是气体的物质的量之比,所以容器内的压强与起始压强之比为(0.9+0.7+0.2)︰2=9:10。
II、(1)实验34是探究温度对反应速率的影响的,所以其它条件应该是相同的,及氯元素的含量应该是74.5%。
(2)根据表中数据对比可知,氯化镁固体含水量越高,催化剂催化效果越差。
(3)根据实验2、3中变化量可知,设计实验2、3的目的是探究粉碎方式对催化剂催化效果的影响的。
III、原电池中必需有电流通过,所以只有氧化还原反应才能设计成原电池,A不是氧化还原反应,不能设计成原电池,B是氧化还原反应,可以设计成原电池。根据方程式可知,铜失去电子,铁离子得到电子,所以铜是负极,正极可以是石墨。电解质是氯化铁溶液。

练习册系列答案
相关题目
 2C(气)+。X D(气)经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/L?min,下列说法中错误的是 ( )
2C(气)+。X D(气)经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/L?min,下列说法中错误的是 ( ) 2NH3(g),在500℃时,将2molN2和2molH2冲入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( )
2NH3(g),在500℃时,将2molN2和2molH2冲入容积为10L的密闭容器中进行反应,达到平衡时,NH3不可能达到的浓度是( ) 2C(g)的反应中,时间t与C的体积分数(C%)的函数关
2C(g)的反应中,时间t与C的体积分数(C%)的函数关
 xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白: Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
 2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4mol。
2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4mol。