题目内容
(21分)恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:
2A(g) + B(g) xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x =
(2)从反应开始到40s达平衡状态,A的平均反应速率为
(3)平衡时容器中B的体积分数为
(4)该温度下此反应的平衡常数表达式为 数值是
(5)在相同温度下,若起始时c(A)="5" mol·L-1,c(B)=6mol·L-1,反应进行一段时间后,测得A的浓度为3mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”)。
2A(g) + B(g)
 xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:(1)x =
(2)从反应开始到40s达平衡状态,A的平均反应速率为
(3)平衡时容器中B的体积分数为
(4)该温度下此反应的平衡常数表达式为 数值是
(5)在相同温度下,若起始时c(A)="5" mol·L-1,c(B)=6mol·L-1,反应进行一段时间后,测得A的浓度为3mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”)。
(每空3分)(1)3 (2)0.01mol·L-1·s-1
(3)40% (4)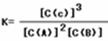 0.75
0.75
(5)否 大于
(3)40% (4)
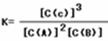 0.75
0.75(5)否 大于
(1)10s时生成物C的物质的量是0.0225mol·L—1·s—1×2L×10s=0.45mol,而消耗A是0.3mol,因此根据变化量之比是相应的化学计量数之比可知x=3。
(2)平衡时B的转化率是20%,所以消耗B是0.4mol,则消耗A是0.8mol,所以A的反应速率是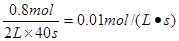 。
。
(3)平衡时ABC的物质的量分别是1.2mol、1.6mol、1.2mol,所以C的体积分数为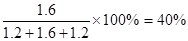 .
.
(4)平衡常数是指在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以表达式为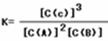 ,其数值为
,其数值为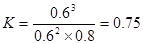 。
。
(5)A的浓度变化量时2.0mol/L,所以消耗B是1.0mol/L,生成C是3.0mol/L,此时B的浓度是5.0mol/L,则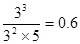 <0.75,所以没有达到平衡状态,此时正反应速率大于逆反应速率。
<0.75,所以没有达到平衡状态,此时正反应速率大于逆反应速率。
(2)平衡时B的转化率是20%,所以消耗B是0.4mol,则消耗A是0.8mol,所以A的反应速率是
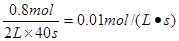 。
。(3)平衡时ABC的物质的量分别是1.2mol、1.6mol、1.2mol,所以C的体积分数为
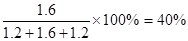 .
.(4)平衡常数是指在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以表达式为
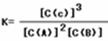 ,其数值为
,其数值为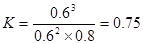 。
。(5)A的浓度变化量时2.0mol/L,所以消耗B是1.0mol/L,生成C是3.0mol/L,此时B的浓度是5.0mol/L,则
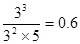 <0.75,所以没有达到平衡状态,此时正反应速率大于逆反应速率。
<0.75,所以没有达到平衡状态,此时正反应速率大于逆反应速率。
练习册系列答案
相关题目
 2NO2(g),不能说明该反应已达到平衡状态的是
2NO2(g),不能说明该反应已达到平衡状态的是 C(g)+D(g)已达到平衡的是
C(g)+D(g)已达到平衡的是 2SO3(g)达到平衡状态。
2SO3(g)达到平衡状态。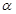 )与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。
)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。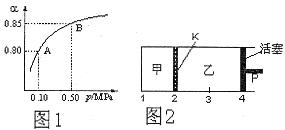
 CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是 ( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是 ( )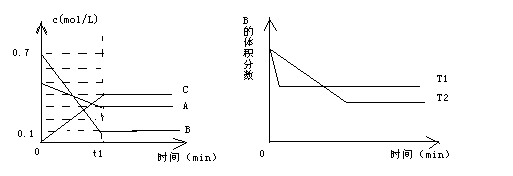
 CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )
CO(g)+3H2(g);△H=+206 kJ/mol,一定条件下向体积为1 L的密闭容器中充入1 mol CH4和1 mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是 ( )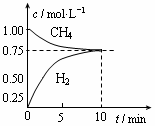
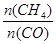 增大
增大