题目内容
【题目】Ca10(PO4)6(OH)2(羟基磷酸钙,简写HAP)是一种新型的环境功能矿物材料,可用于除去水体中的F-、Cd2+、Pb2+及Cu2+等。
(1)制备HAP的步骤如下:分别配制250mL浓度均为0.5 mol·L-1的Ca(NO3)2溶液和(NH4)2HPO4溶液(pH约为8),按n(Ca)/n(P)=1.67分别量取相应体积的溶液,加热至50℃,不断搅拌下,按特定的方式加料,强力搅拌1h,再经后续处理得到产品。
①特定的加料方式是__________ (填序号)。
a.将Ca(NO3)2溶液逐滴滴入(NH4)2HPO4溶液中,再用氨水调节pH至10.5
b.将(NH4)2HPO4溶液逐滴滴入Ca(NO3)2溶液中,再用氨水调节pH至10.5
c.将(NH4)2HPO4溶液和氨水混合并调节pH至10.5,再滴入Ca(NO3)2溶液
②反应生成Ca10(PO4)6(OH)2的离子方程式为__________。
(2)HAP脱除F-的操作是:在聚四氟乙烯烧杯中加入50mL10mg·L-1NaF溶液和0.15gCa10(PO4)6(OH)2,在恒温下振荡,每隔1h测定一次溶液中F-浓度,直至达到吸附平衡。
①实验中“烧杯”材质用“聚四氟乙烯”塑料而不用玻璃,其原因是__________。
②除氟反应形式之一是:Ca10(PO4)6(OH)2+20F-![]() 10CaF2+6PO43-+2OH-,该反应的平衡常数K=__________[用Ksp(CaF2)和Ksp(HAP)表示]。
10CaF2+6PO43-+2OH-,该反应的平衡常数K=__________[用Ksp(CaF2)和Ksp(HAP)表示]。
(3)HAP脱除Pb(Ⅱ)包括物理吸附和溶解-沉淀吸附。物理吸附时,HAP的特定位可吸附溶液中某些阳离子;溶解-沉淀吸附的机理为:
Ca10(PO4)6(OH)2(s)+2H+(aq)![]() 10Ca2+(aq)+6PO43-(aq)+2H2O(l)(溶解)
10Ca2+(aq)+6PO43-(aq)+2H2O(l)(溶解)
10Pb2+(aq)+6PO43-(aq)+2H2O(l)![]() Pb10(PO4)6(OH)2(s)+2H+(aq)(沉淀)
Pb10(PO4)6(OH)2(s)+2H+(aq)(沉淀)
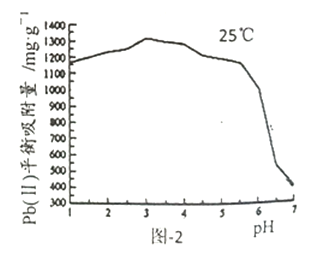
已知Pb(Ⅱ)的分布分数如图-1所示;一定条件下HAP对Pb(1)平衡吸附量与pH的关系如图-2所示。
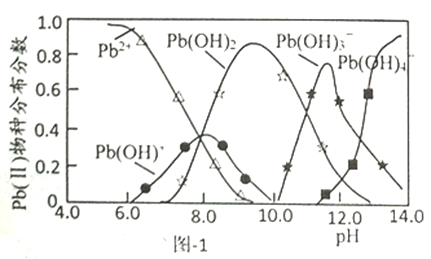
①能使甲基橙显红色的Pb(Ⅱ)溶液中滴入少量NaOH至溶液呈中性,该过程中主要反应的离子方程式为__________。
②当pH<3.0时,pH越小HAP对Pb(Ⅱ)平衡吸附量稍减小,其原因是__________。
③当pH>7.0时,生成的沉淀为__________(填化学式);此时pH越大HAP对Pb(Ⅱ)平衡吸附量越小,其原因是__________。
【答案】 b 10Ca2++6HPO42-+8NH3·H2O![]() Ca10(PO4)6(OH)2↓+8NH4++6H2O 防止F-及其水解生成的HF与玻璃中SiO2反应 Ksp(HAP)/K10sp(CaF2) Pb2++OH-=Pb(OH)+ 溶液中c(H+)大,大量H+占据HAP对Pb2+的吸附位,物理吸附能力减弱 Pb10(PO4)6(OH)2和Pb(OH)2 c(H+)减小,会减少HAP在溶液中的溶解量,便生成的c(PO43-)减小,溶解-沉淀吸附能力减弱且改变了吸附机理
Ca10(PO4)6(OH)2↓+8NH4++6H2O 防止F-及其水解生成的HF与玻璃中SiO2反应 Ksp(HAP)/K10sp(CaF2) Pb2++OH-=Pb(OH)+ 溶液中c(H+)大,大量H+占据HAP对Pb2+的吸附位,物理吸附能力减弱 Pb10(PO4)6(OH)2和Pb(OH)2 c(H+)减小,会减少HAP在溶液中的溶解量,便生成的c(PO43-)减小,溶解-沉淀吸附能力减弱且改变了吸附机理
【解析】(1)①特定的加料方式是将(NH4)2HPO4溶液逐滴滴入Ca(NO3)2溶液中,防止发生双水解而产生磷酸钙等杂质,再用氨水调节pH至10.5,答案选b;②(NH4)2HPO4 、Ca(NO3)2及NH3·H2O反应生成Ca10(PO4)6(OH)2的离子方程式为10Ca2++6HPO42-+8NH3·H2O![]() Ca10(PO4)6(OH)2↓+8NH4++6H2O;(2)①防止F-及其水解生成的HF与玻璃中SiO2反应,故实验中“烧杯”材质用“聚四氟乙烯”塑料而不用玻璃;②反应Ca10(PO4)6(OH)2+20F-
Ca10(PO4)6(OH)2↓+8NH4++6H2O;(2)①防止F-及其水解生成的HF与玻璃中SiO2反应,故实验中“烧杯”材质用“聚四氟乙烯”塑料而不用玻璃;②反应Ca10(PO4)6(OH)2+20F-![]() 10CaF2+6PO43-+2OH-的平衡常数K=
10CaF2+6PO43-+2OH-的平衡常数K=![]() ;(3)①能使甲基橙显红色的Pb(Ⅱ)溶液中滴入少量NaOH至溶液呈中性,该过程中主要反应是Pb2+与OH-反应转化为Pb(OH)+,反应的离子方程式为Pb2++OH-=Pb(OH)+;②当pH<3.0时,pH越小HAP对Pb(Ⅱ)平衡吸附量稍减小,其原因是溶液中c(H+)大,大量H+占据HAP对Pb2+的吸附位,物理吸附能力减弱;③由图中信息可知,当pH>7.0时,生成的沉淀为Pb10(PO4)6(OH)2和Pb(OH)2;此时pH越大HAP对Pb(Ⅱ)平衡吸附量越小,其原因是c(H+)减小,会减少HAP在溶液中的溶解量,便生成的c(PO43-)减小,溶解-沉淀吸附能力减弱且改变了吸附机理。
;(3)①能使甲基橙显红色的Pb(Ⅱ)溶液中滴入少量NaOH至溶液呈中性,该过程中主要反应是Pb2+与OH-反应转化为Pb(OH)+,反应的离子方程式为Pb2++OH-=Pb(OH)+;②当pH<3.0时,pH越小HAP对Pb(Ⅱ)平衡吸附量稍减小,其原因是溶液中c(H+)大,大量H+占据HAP对Pb2+的吸附位,物理吸附能力减弱;③由图中信息可知,当pH>7.0时,生成的沉淀为Pb10(PO4)6(OH)2和Pb(OH)2;此时pH越大HAP对Pb(Ⅱ)平衡吸附量越小,其原因是c(H+)减小,会减少HAP在溶液中的溶解量,便生成的c(PO43-)减小,溶解-沉淀吸附能力减弱且改变了吸附机理。

【题目】用废雷尼镍(主要成分为NiO、Al,少量Cr、Fe、C、S及有机物)制备Ni(NO3)2·6H2O的实验流程如下:
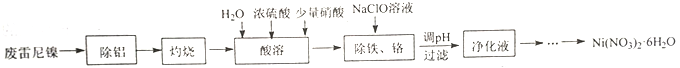
已知:①在实验条件下,Ni2+、Cr3+在溶液中不能被NaClO或HNO3氧化。
②NiSO4易溶于水,NiCO3难溶于水;Ni(NO3)2在20℃、90℃时溶解度依次为79.2、188g/100g水。
③己知“酸溶”后的溶液中主要的四种离子开始沉淀与沉淀完全的pH如下:
Ni2+ | Fe2+ | Fe3+ | Cr3+ | |
开始沉淀pH | 6.2 | 7.6 | 2.3 | 4.5 |
沉淀完全pH | 8.5 | 9.1 | 3.3 | 5.6 |
(1)“除铝”所用试剂及主要操作为__________。
(2)“灼烧”的主要目的是__________。
(3)“酸溶”时,用浓硫酸和水代替稀硫酸的目的是__________。
(4)“除铁、铬”时,Fe2+被氧化为Fe3+的离子方程式为__________;氧化后需将溶液pH调整到的范围是__________。
(5)请设计由“净化液”制取Ni(NO3)2·6H2O的实验方案:__________,离心分离、洗涤、干燥得Ni(NO3)2·6H2O (实验中须使用的试剂有:6mol·L-1硝酸,3 mol·L-1Na2CO3溶液)。