题目内容
某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现如图所示的变化.

请回答下列问题.
(1)图中涉及分离溶液与沉淀的方法是 .
(2)B、C、D、3种物质的化学式为:B 、C 、D
(3)沉淀F与NaOH溶液反应的离子方程式为 .沉淀E与稀硫酸反应的离子方程式为 .溶液G与过量稀氨水反应的化学方程式为 .

请回答下列问题.
(1)图中涉及分离溶液与沉淀的方法是
(2)B、C、D、3种物质的化学式为:B
(3)沉淀F与NaOH溶液反应的离子方程式为
考点:无机物的推断
专题:
分析:A溶于水得沉淀和溶液,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液G是硫酸铝溶液,沉淀F是氧化铝和氧化铁,将沉淀F溶于过量氢氧化钠溶液中,氧化铝能和氢氧化钠反应,氧化铁和氢氧化钠不反应,所以沉淀C是氧化铁,溶液D是偏铝酸钠溶液,溶液G中加入过量的氨水得到沉淀E为氢氧化铝,氢氧化铝与氢氧化钠溶液反应得到偏铝酸钠,将氢氧化铝加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵.
解答:
解:A溶于水得沉淀和溶液,硫酸铝易溶于水,氧化铝、氧化铁不易溶于水,所以得到的溶液G是硫酸铝溶液,沉淀F是氧化铝和氧化铁,将沉淀F溶于过量氢氧化钠溶液中,氧化铝能和氢氧化钠反应,氧化铁和氢氧化钠不反应,所以沉淀C是氧化铁,溶液D是偏铝酸钠,溶液G中加入过量的氨水得到沉淀E为氢氧化铝,氢氧化铝与氢氧化钠溶液反应得到偏铝酸钠,将氢氧化铝加热得到沉淀B,B是氧化铝,硫酸铝和氨水反应生成氢氧化铝和硫酸铵,
(1)分离溶液和固体的操作是过滤,故答案为:过滤;
(2)通过以上分析知,B是Al2O3,C是Fe2O3,D是NaAlO2,E是Al(OH)3,
故答案为:Al2O3;Fe2O3;NaAlO2;
(3)沉淀F与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+2H2O,沉淀E与稀硫酸反应的离子方程式为:Al(OH)3+2H+=Al3++3H2O,溶液G与过量稀氨水反应的化学方程式为:Al2(SO4)3+6NH3.H2O=2Al(OH)3↓+3(NH4)2SO4,
故答案为:Al2O3+2OH-=2AlO2-+2H2O;Al(OH)3+2H+=Al3++3H2O;Al2(SO4)3+6NH3.H2O=2Al(OH)3↓+3(NH4)2SO4.
(1)分离溶液和固体的操作是过滤,故答案为:过滤;
(2)通过以上分析知,B是Al2O3,C是Fe2O3,D是NaAlO2,E是Al(OH)3,
故答案为:Al2O3;Fe2O3;NaAlO2;
(3)沉淀F与NaOH溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+2H2O,沉淀E与稀硫酸反应的离子方程式为:Al(OH)3+2H+=Al3++3H2O,溶液G与过量稀氨水反应的化学方程式为:Al2(SO4)3+6NH3.H2O=2Al(OH)3↓+3(NH4)2SO4,
故答案为:Al2O3+2OH-=2AlO2-+2H2O;Al(OH)3+2H+=Al3++3H2O;Al2(SO4)3+6NH3.H2O=2Al(OH)3↓+3(NH4)2SO4.
点评:本题为框图型物质推断题,完成此类题目,可以依据题干提供的信息,结合框图,找准解题的突破口,直接得出物质,然后顺推或逆推或由两边向中间推得出其他物质.

练习册系列答案
相关题目
下列四个图示中,属于过滤操作的是( )
A、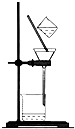 |
B、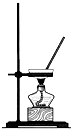 |
C、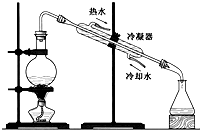 |
D、 |
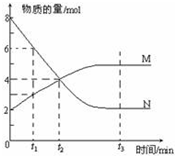 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示: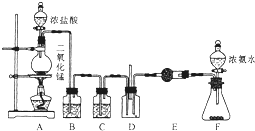 某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应.其中A、F为氯气和氨气的发生装置,D为纯净、干燥的氯气与氨气反应的装置.
某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应.其中A、F为氯气和氨气的发生装置,D为纯净、干燥的氯气与氨气反应的装置.