题目内容
11.标准状况下,1体积水中能溶解500体积的HCl气体.若向水中通入标准状况下的44.8LHCl气体配成1L溶液,假设气体完全溶解.请回答:(1)所得溶液中含HCl的物质的量浓度为2mol/L;
(2)从该溶液中取出10mL溶解于水配制成250mL溶液,配制后的稀溶液中含HCl物质的量浓度为0.08mol/L.
(3)配制过程中,造成浓度偏低的操作可能有BCD(选填下列操作的序号).
A、容量瓶用蒸馏水洗后未干燥
B、量筒用蒸馏水洗后未干燥
C、将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量中加水到刻度
D、用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线
E、定容时,俯视液面加水至刻度线.
分析 (1)依据C=$\frac{n}{V}$计算溶液中含HCl的物质的量浓度;
(2)依据溶液稀释前后所含溶质的物质的量不变计算配置后的稀溶液中含HCl物质的量浓度;
(3)分析不当操作对溶质的物质的量和溶液体积的影响,依据c=$\frac{n}{V}$进行误差分析.
解答 解:(1)准状况下的44.8L HCl气体的物质的量=$\frac{44.8L}{22.4L/mol}$=2mol,溶于水配成1L溶液,所得溶液中含HCl的物质的量浓度为:$\frac{2mol}{1L}$=2mol/L,故答案为:2mol/L;
(2)设从该溶液中取出10mL浓盐酸溶解于水配置成250mL溶液,配置后的稀溶液中含HCl物质的量浓度为C,依据溶液稀释前后所含溶质的物质的量不变得:
C×250mL=2×10mL,解得C=0.08mol/L,故答案为:0.08mol/L;
(3)A.容量瓶用蒸馏水洗后未干燥,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故A不选;
B.量筒用蒸馏水洗后未干燥,导致量取的氯化氢的物质的量偏小,溶液浓度偏低,故B选;
C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量瓶中加水到刻度,导致溶质的物质的量偏小,溶液浓度偏小,故C选;
D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线,导致溶质的物质的量偏小,溶液浓度偏小,故D选;
E.定容时,俯视液面加水至刻度线,导致溶液体积偏小,溶液浓度偏大,故E不选;
故答案为:BCD.
点评 本题考查了有关物质的量浓度计算及一定物质的量浓度溶液的配制,明确相关公式及配制原理是解题关键,注意误差分析的方法.

练习册系列答案
相关题目
2.化学与生活、社会密切相关,下列说法不正确的是( )
| A. | 碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金 | |
| B. | 氨很容易液化,液氨气化吸收大量的热,所以液氨常用作致冷剂 | |
| C. | Al2O3用作耐火材料、Al(OH)3用作阻燃剂 | |
| D. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 |
19.检验SO2中是否含有CO2应采用的方法是( )
| A. | 通过澄清石灰水 | |
| B. | 先通过NaHCO3溶液,再通过澄清石灰水 | |
| C. | 通过品红溶液 | |
| D. | 先通过足量的酸性高锰酸钾溶液,再通过澄清石灰水 |
6.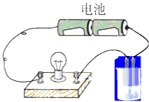 用图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是( )
用图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是( )
 用图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是( )
用图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是( )| A. | 向亚硫酸钠溶液中通入氯气 | B. | 向硝酸银溶液中通入少量氯化氢 | ||
| C. | 向氢碘酸饱和溶液中通入少量氧气 | D. | 向氢氧化钠溶液中通入少量氯气 |
20.今有如下三个热化学方程式:
H2(g)+$\frac{1}{2}$ O2 (g)═H2O (g)△H=a kJ•mol-1
H2 (g)+$\frac{1}{2}$ O2 (g)═H2O (l)△H=b kJ•mol-1
2H2 (g)+O2 (g)═2H2O (g)△H=c kJ•mol-1
关于它们的下列表述正确的是( )
H2(g)+$\frac{1}{2}$ O2 (g)═H2O (g)△H=a kJ•mol-1
H2 (g)+$\frac{1}{2}$ O2 (g)═H2O (l)△H=b kJ•mol-1
2H2 (g)+O2 (g)═2H2O (g)△H=c kJ•mol-1
关于它们的下列表述正确的是( )
| A. | 它们都是吸热反应 | B. | a、b和c均为正值 | ||
| C. | a=b | D. | 2a=c |
1.将pH=4的酸性溶液与pH=10的NaOH溶液等体积混合后,溶液的pH可能是( )
| A. | 等于7 | B. | 大于7 | C. | 小于7 | D. | 无法确定 |

 .
.