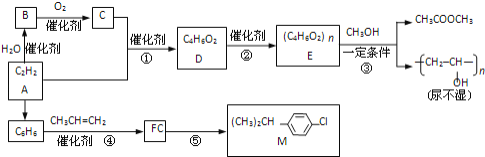
��Ŀ����
����Ŀ���ش��������⣺
(1)��̬̼ԭ�ӵĺ�������Ų�ʽΪ______���ǽ���Ԫ��![]() �ĵ�һ�����ܴ���
�ĵ�һ�����ܴ���![]() �ĵ�һ�����ܣ�ԭ����______��
�ĵ�һ�����ܣ�ԭ����______��
(2)�±��ǵ������ڲ���Ԫ�صĵ�����[��λ��[![]() (���ӷ���)]���ݡ�
(���ӷ���)]���ݡ�
Ԫ�� |
|
|
|
�� | 5.7 | 47.4 | 71.8 |
�� | 7.7 | 15.1 | 80.3 |
�� | 13.0 | 23.9 | 40.0 |
�� | 15.7 | 27.6 | 40.7 |
����˵����ȷ����______(�����)��
A.�Ľ����Ա���ǿ
B.����![]() ��
��
C.��������Ϊ�ǽ���Ԫ��
D.��һ��Ϊ����Ԫ��
(3)![]() ��
��![]() ��Ϊ�������ڹ��ɽ���Ԫ�أ���Ԫ�صIJ��ֵ��������������±���
��Ϊ�������ڹ��ɽ���Ԫ�أ���Ԫ�صIJ��ֵ��������������±���
Ԫ�� |
|
| |
������/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
��Ԫ��λ�ڵ������ڵڢ�B�塣��д����̬![]() �ļ۵����Ų�ʽ��______���Ƚ���Ԫ�ص�I2��I3��֪����̬
�ļ۵����Ų�ʽ��______���Ƚ���Ԫ�ص�I2��I3��֪����̬![]() ��ʧȥ1�����ӱ���̬
��ʧȥ1�����ӱ���̬![]() ��ʧȥ1�������ѣ��Դ���Ľ�����______��
��ʧȥ1�������ѣ��Դ���Ľ�����______��
(4)±��Ԫ��![]() ��
��![]() ��
��![]() ��
��![]() �ĵ縺����С�����˳����______��
�ĵ縺����С�����˳����______��
(5)��̬![]() ԭ�ӵĵ����Ų�ʽΪ______��
ԭ�ӵĵ����Ų�ʽΪ______��![]() ��
��![]() ��ȣ��縺�Խϴ����______��
��ȣ��縺�Խϴ����______��![]() ��
��![]() Ԫ�صĻ��ϼ�Ϊ______��
Ԫ�صĻ��ϼ�Ϊ______��
���𰸡�![]()
![]() ԭ�ӵ�
ԭ�ӵ�![]() ����ﵽ�����״̬���Ƚ��ȶ� A
����ﵽ�����״̬���Ƚ��ȶ� A ![]() ��
��![]() ת��Ϊ
ת��Ϊ![]() ʱ��
ʱ��![]() �ܼ��ɽ��ȶ���
�ܼ��ɽ��ȶ���![]() �����״̬ת��Ϊ���ȶ���
�����״̬ת��Ϊ���ȶ���![]() ״̬��Ҫ�������϶ࣻ��
״̬��Ҫ�������϶ࣻ��![]() ת��Ϊ
ת��Ϊ![]() ʱ��
ʱ��![]() �ܼ��ɲ��ȶ���
�ܼ��ɲ��ȶ���![]() ״̬ת��Ϊ���ȶ���
״̬ת��Ϊ���ȶ���![]() �����״̬��Ҫ���������Ҫ��
�����״̬��Ҫ���������Ҫ�� ![]()
![]()
![]()
![]()
��������
��1��C��ԭ������Ϊ6�����̬ԭ�ӵĺ�������Ų�ʽΪ1s22s22p2��Oԭ�Ӻ�Nԭ�ӵ���Χ�����Ų�ʽ�ֱ�Ϊ2s22p4��2s22p3�����ѿ���Nԭ�ӵ�2p������ڰ����״̬���Ƚ��ȶ����ʵ�һ�����ܽϴʴ�Ϊ��1s22s22p2��![]() ԭ�ӵ�
ԭ�ӵ�![]() ����ﵽ�����״̬���Ƚ��ȶ���
����ﵽ�����״̬���Ƚ��ȶ���
��2���ס��ҡ�������Ϊ��������Ԫ�أ���Ԫ�صĵ�һ������ԶԶС�ڵڶ������ܣ�˵����Ԫ���������1�����ӣ�ʧȥ1������ʱ�ﵽ�ȶ��ṹ�����Լ�ΪNaԪ�أ���Ԫ�صĵڶ�������ԶԶС�ڵ��������ܣ���BԪ���������2�����ӣ�ʧȥ�������Ӻ�ﵽ�ȶ��ṹ��������ΪMgԪ�أ�������Ԫ�صĵ�һ���롢�ڶ������ܡ���������������˵����Ԫ����������3�����ӣ�������Ϊ�ǽ���Ԫ�أ���һ��Ϊ�ǽ���Ԫ�أ���������������֪��A����ΪNaԪ�أ���ΪMgԪ�أ��ʼĽ����Ա���ǿ����A��ȷ��B����ΪMgԪ�أ����ϼ�Ϊ+2�ۣ���B����C. ��ΪMgԪ�أ�������Ԫ�صĵ�һ���롢�ڶ������ܡ���������������˵����Ԫ����������3�����ӣ�������Ϊ�ǽ���Ԫ�أ���C����D. ������Ԫ�صĵ�һ���롢�ڶ������ܡ���������������˵����Ԫ����������3�����ӣ���һ��Ϊ�ǽ���Ԫ�أ�D����ѡA��
��3����Ԫ��λ�ڵ������ڵڢ�B�壬���̬ԭ�ӵļ۵����Ų�ʽΪ��3d54s2�������̬![]() �ļ۵����Ų�ʽ��3d5����
�ļ۵����Ų�ʽ��3d5����![]() ת��Ϊ
ת��Ϊ![]() ʱ��
ʱ��![]() �ܼ��ɽ��ȶ���
�ܼ��ɽ��ȶ���![]() �����״̬ת��Ϊ���ȶ���
�����״̬ת��Ϊ���ȶ���![]() ״̬��Ҫ�������϶ࣻ��
״̬��Ҫ�������϶ࣻ��![]() ת��Ϊ
ת��Ϊ![]() ʱ��
ʱ��![]() �ܼ��ɲ��ȶ���
�ܼ��ɲ��ȶ���![]() ״̬ת��Ϊ���ȶ���
״̬ת��Ϊ���ȶ���![]() �����״̬��Ҫ���������Ҫ�٣�����̬
�����״̬��Ҫ���������Ҫ�٣�����̬![]() ��ʧȥ1�����ӱ���̬
��ʧȥ1�����ӱ���̬![]() ��ʧȥ1�������ѣ�
��ʧȥ1�������ѣ�
��4�����ݵ縺�Եı仯���ɿ�֪��±��Ԫ��![]() ��
��![]() ��
��![]() ��
��![]() �ĵ縺����С�����˳����
�ĵ縺����С�����˳����![]() ��
��
��5����̬![]() ԭ�ӵĵ����Ų�ʽΪ��
ԭ�ӵĵ����Ų�ʽΪ��![]() ��ͬһ���ڴ�������Ԫ��ԭ�ӵĵ縺�����ʵ縺��N��B��BΪ�ڶ����ڢ�A��Ԫ�أ����̬ԭ�ӵĵ����Ų�ʽΪ��1s22s22p1��BN��N��-3�ۣ���B��+3�ۣ��ʴ�Ϊ��
��ͬһ���ڴ�������Ԫ��ԭ�ӵĵ縺�����ʵ縺��N��B��BΪ�ڶ����ڢ�A��Ԫ�أ����̬ԭ�ӵĵ����Ų�ʽΪ��1s22s22p1��BN��N��-3�ۣ���B��+3�ۣ��ʴ�Ϊ��![]() ��N��+3��
��N��+3��

����Ŀ����ͬԪ�ص�ԭ���������ӵ�������С����һ����ֵX��ʾ��XֵԽ����ԭ���������ӵ�����Խǿ�������γɵĻ�������Ϊ������ɵ�һ�����±���ijЩԪ�ص�Xֵ��
Ԫ�ط��� |
|
|
|
|
|
|
Xֵ | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
Ԫ�ط��� |
|
|
|
|
|
|
Xֵ | 0.93 | 1.60 | 1.90 | 2.19 | 2.55 | 3.16 |
(1)ͨ������Xֵ�ı仯���ɣ�ȷ��![]() ��
��![]() ��Xֵ��Χ��______
��Xֵ��Χ��______![]() ______��______
______��______![]() ______��
______��
(2)�Ʋ�Xֵ��ԭ�Ӱ뾶�Ĺ�ϵΪ______��
(3)ij�л�������ĽṹΪ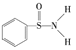 ������
������![]() ���У�����Ϊ���õ��Ӷ�ƫ��______(��Ԫ�ط���)��
���У�����Ϊ���õ��Ӷ�ƫ��______(��Ԫ�ط���)��
(4)���XֵΪ�縺�Ե���ֵ�����ƶ�![]() �л�ѧ��������Ϊ______��
�л�ѧ��������Ϊ______��
(5)Ԥ��Ԫ�����ڱ���Xֵ��С��Ԫ��(������Ԫ�س���)��______(��Ԫ�ط���)��