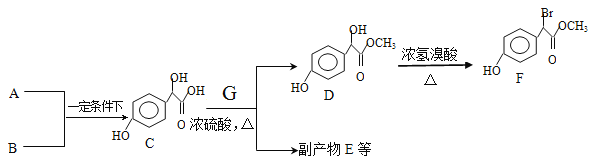
题目内容
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
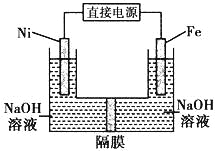
A. 镍是阳极,电极反应为4OH--4e一= O2↑+ 2 H2O
B. 电解时电流的方向为:负极→Ni电极→溶液→Fe电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
【答案】D
【解析】试题分析:A、因为该装置制备高铁酸盐,所以Fe发生氧化反应,则Fe作阳极,错误;B、Ni则作阴极,Fe与电源的正极相连,所以电流的方向是正极-Fe极-溶液-Ni极-负极,错误;C、若隔膜为阴离子交换膜,则氢氧根离子向阳极移动,自左向右移动,错误;D、阳极是Fe失去电子与氢氧根离子结合为FeO42-和水,所以阳极区氢氧根离子浓度减小,pH降低;而阴极是氢离子放电生成氢气,造成阴极区氢氧根离子浓度增大,pH升高,总反应是Fe+2H2O+2OH-= FeO42-+3H2,当撤去隔膜后,因为整体消耗氢氧根离子,所以溶液的氢氧根离子浓度减小,pH降低,正确,答案选D。

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目