题目内容
在一种酸性溶液中,可能存在NO3—、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下推测中不正确的是( )
| A.一定有碘离子 | B.可能含铁离子 |
| C.可能有氯离子 | D.不含硝酸根离子 |
B
解析

已知KClO3与浓HCI反应的化学方程式为:KClO3+6HCl=KCl+3C12+3H2O,若用K35C1O3与H37Cl作用,则下列说法正确的是 ( )
| A.所得氯气的相对分子质量约为71 |
| B.KCl中只含35C1 |
| C.所得的KCl中既含35C1又含37Cl |
| D.被氧化和被还原的氯原子数之比为5∶1 |
某氮的氧化物和CO在催化剂的作用下充分反应,生成氮气和CO2 ,若测得氮气和CO2的物质的量之比为1:2,则该氮的氧化物是
| A.N2O | B.N2O5 | C.NO2 | D.NO |
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下: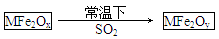
则下列判断正确的是
| A.MFe2Ox是还原剂 |
| B.SO2是该反应的催化剂 |
| C.x>y |
| D.SO2发生了置换反应 |
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和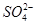 )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
| A.9.0 L | B.13.5 L | C.15.7 L | D.16.8 L |
将一定量的氯气通入30 mL浓度为10.00 mol·L-1的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
| A.与NaOH反应的氯气一定为0.3 mol |
| B.n(Na+)∶n(Cl-)可能为7∶3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1 |
将一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol/L,则下列叙述中错误的是( )
| A.反应中消耗的Zn的质量为97.5 g |
| B.气体A中SO2和H2的体积比为1∶4 |
| C.反应中被还原的元素只有一种 |
| D.反应中共转移电子3 mol |
铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2 2PbO+2SO2;③制粗铅:PbO+C
2PbO+2SO2;③制粗铅:PbO+C Pb+CO↑;PbO+CO
Pb+CO↑;PbO+CO Pb+CO2。
Pb+CO2。
下列说法正确的是( )
| A.浮选法富集方铅矿的过程属于化学变化 |
| B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO |
| C.整个冶炼过程中,制取1 mol Pb共转移2 mol电子 |
| D.将l mol PbS完全冶炼成Pb理论上至少需要6 g碳 |
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 molL-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法不正确的是 ( )。
| A.Cu与Cu2O的物质的量之比为2∶1 |
| B.硝酸的物质的量浓度为2.6 mol·L-1 |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol |