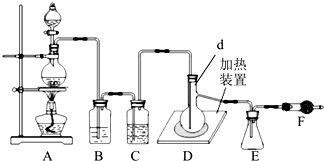
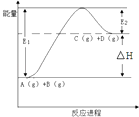
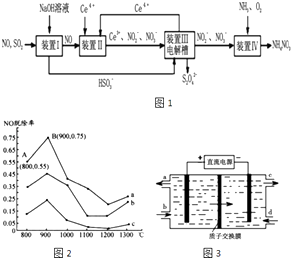
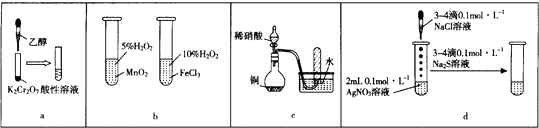
题目内容
【题目】常温下,将0.1molL﹣1氢氧化钠溶液与0.06molL﹣1硫酸溶液等体积混合,该混合溶液的pH等于( )lg2=0.3.
A.1.7
B.2.0
C.12.0
D.11.7
【答案】B
【解析】解:常温下氢氧化钠溶液物质的量浓度为0.1mol/L,设溶液的体积都是1L,则氢氧化钠的物质的量为:1L×0.1molL﹣1=0.1mol, 硫酸的物质的量为:1L×0.06molL﹣1=0.06mol,含有H+的物质的量为0.06mol×2=0.12mol,
酸碱发生中和时H+和OH﹣的物质的量分别为0.12mol和0.1mol,则硫酸过量,过量的H+的物质的量为:0.12mol﹣0.1mol=0.02mol,
反应后溶液中H+的物质的量浓度为:c(H+)= ![]() =0.01 molL﹣1 ,
=0.01 molL﹣1 ,
该混合液的pH=﹣lg10﹣2=2.0,
故选B.

练习册系列答案
相关题目