��Ŀ����
����Ŀ����Ⱦ�����Чȥ������Դ�ij�������ǻ�ѧ�츣�������Ҫ�о����⣮�����������γ����ꡢ�����Ȼ�����Ⱦ��������ף����ú��ʵĴ�ʩ��������Ⱦ�DZ�����������Ҫ��ʩ��
��1�����о���������NH3���������Ṥҵβ���е�NO��Ⱦ��NH3��NO�����ʵ���֮�ȷֱ�Ϊ1��3��3��l��4��1ʱ��NO�ѳ������¶ȱ仯��������ͼ2��ʾ��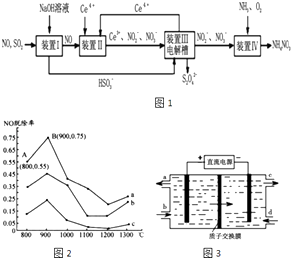
������a�У�NO����ʼŨ��Ϊ6��10��4mg/m3 �� ��A�㵽B�㾭��0.8s����ʱ�����NO���ѳ�����Ϊmg/��m3s����
������b��Ӧ��NH3��NO�����ʵ���֮���� �� ��������
����֪��25�棬101kPaʱ��
N2��g��+3H2��g���T2NH3��g����H=��Q1/mol
2H2��g��+O2��g���T2H2O��1����H=��Q2kJ/mo1
N2��g��+O2��g���T2NO��g����H=+Q3kJ/mo1��
��д����NH3�ѳ�NO���Ȼ�ѧ����ʽ ��
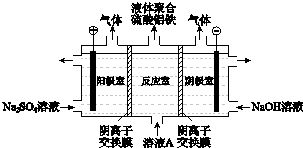
��2����ҵ�ϻ����Ա䡰�ϡ�Ϊ���������������ﺬ�е�SO2��NO����Ⱦ��ת��ΪNa2S2O4�����շۣ���NH4NO3�Ȼ�����Ʒ��������������ͼ1����װ�â���NOת��ΪNO3���ķ�Ӧ�����ӷ���ʽΪ ��
��װ�â��Ƶ�Na2S2O4��ͬʱ������Ce4+������ԭ����ͼ3��ʾ���������ĵ缫��ӦʽΪ�� ��
�۰��������̴�������amolSO2��bmolNO��������b��a��������ȡNa2S2O4��NH4NO3 �� װ�â���SO2��װ�â���NO��װ�â���HSO3����Ce3+��װ�â���NO2��ȫ��ת����������Ϻ�װ�â���Ce4+��ʣ��������������û�б仯������������װ�â���ͨ���״���µ�O2L���ú�a��b�Ĵ���ʽ��ʾ����
���𰸡�
��1��1.5��10��4��3��1��NH3��NO�����ʵ�����ֵԽ��NO���ѳ���Խ��4NH3��g��+6NO��g���T5N2��g��+6H2O��1����H=��3Q2��2Q1��3Q3��KJ/mol
��2��3Ce4++NO+2H2O�T3Ce3++NO3��+4H+��2HSO3��+2e��+2H+�TS2O42��+2H2O��5.6��3b��a��
���������⣺��1��������a�У�NO����ʼŨ��Ϊ6��10��4mg/m3 �� A����ѳ���Ϊ55%��B����ѳ���Ϊ75%����A�㵽B�㾭��0.8 s����ʱ�����NO���ѳ�����= ![]() =1.5��10��4mg/��m3s�������Դ��ǣ�1.5��10��4����NH3��NO�����ʵ����ı�ֵԽ��NO�ѳ���Խ�������ʵ���֮�ȷֱ�Ϊ1��3��3��1��4��1ʱ����Ӧ������Ϊc��b��a��������b ��ӦNH3��NO�����ʵ���֮����3��1�����Դ��ǣ�3��1��NH3��NO�����ʵ�����ֵԽ��NO���ѳ���Խ����֪��25�棬101kPaʱ����N2��g��+3H2��g���T2NH3��g����H=��Q1/mol��2H2��g��+O2��g���T2H2O��1����H=��Q2kJ/mo1��N2��g��+O2��g���T2NO��g����H=+Q3kJ/mo1����NH3�ѳ�NO�Ļ�ѧ����ʽΪ4 NH3��g��+6 NO��g���T5 N2��g��+6 H2O��1�����ɸ��ݸ��¶��ɣ���3���ک�2���٩�3���ۿɵ��Ȼ�ѧ����ʽ4 NH3��g��+6 NO��g���T5 N2��g��+6 H2O��1����H=��3Q2��2Q1��3Q3��KJ/mol�� ���Դ��ǣ�4 NH3��g��+6 NO��g���T5 N2��g��+6 H2O��1����H=��3Q2��2Q1��3Q3��KJ/mol����2����SO2��NO�Ǵ�����Ⱦ�ͨ������������Һ���յõ����������ƣ�һ����������Ӧ��ͨ��װ�â����Ce4+������ԭ��Ӧ�õ�Ce3+��NO2����NO3���ȣ������������ƻ�ϣ��ڵ�����ͨ����õ�Ce4+ѭ��ʹ�ã����Na2S2O4 �� NO2����NO3���ȼ��백����������װ�â��з�����Ӧ�õ�NH4NO3��Ʒ����װ�â���NOת��ΪNO3���ķ�Ӧ�����ӷ���ʽΪ3Ce4++NO+2H2O�T3Ce3++NO3��+4H+ �� ���Դ��ǣ�3Ce4++NO+2H2O�T3Ce3++NO3��+4H+��
=1.5��10��4mg/��m3s�������Դ��ǣ�1.5��10��4����NH3��NO�����ʵ����ı�ֵԽ��NO�ѳ���Խ�������ʵ���֮�ȷֱ�Ϊ1��3��3��1��4��1ʱ����Ӧ������Ϊc��b��a��������b ��ӦNH3��NO�����ʵ���֮����3��1�����Դ��ǣ�3��1��NH3��NO�����ʵ�����ֵԽ��NO���ѳ���Խ����֪��25�棬101kPaʱ����N2��g��+3H2��g���T2NH3��g����H=��Q1/mol��2H2��g��+O2��g���T2H2O��1����H=��Q2kJ/mo1��N2��g��+O2��g���T2NO��g����H=+Q3kJ/mo1����NH3�ѳ�NO�Ļ�ѧ����ʽΪ4 NH3��g��+6 NO��g���T5 N2��g��+6 H2O��1�����ɸ��ݸ��¶��ɣ���3���ک�2���٩�3���ۿɵ��Ȼ�ѧ����ʽ4 NH3��g��+6 NO��g���T5 N2��g��+6 H2O��1����H=��3Q2��2Q1��3Q3��KJ/mol�� ���Դ��ǣ�4 NH3��g��+6 NO��g���T5 N2��g��+6 H2O��1����H=��3Q2��2Q1��3Q3��KJ/mol����2����SO2��NO�Ǵ�����Ⱦ�ͨ������������Һ���յõ����������ƣ�һ����������Ӧ��ͨ��װ�â����Ce4+������ԭ��Ӧ�õ�Ce3+��NO2����NO3���ȣ������������ƻ�ϣ��ڵ�����ͨ����õ�Ce4+ѭ��ʹ�ã����Na2S2O4 �� NO2����NO3���ȼ��백����������װ�â��з�����Ӧ�õ�NH4NO3��Ʒ����װ�â���NOת��ΪNO3���ķ�Ӧ�����ӷ���ʽΪ3Ce4++NO+2H2O�T3Ce3++NO3��+4H+ �� ���Դ��ǣ�3Ce4++NO+2H2O�T3Ce3++NO3��+4H+��
������������ԭ��Ӧ���缫����ʽΪ2HSO3��+2e��+2H+�TS2O42��+2H2O�����Դ��ǣ�2HSO3��+2e��+2H+�TS2O42��+2H2O����5��amolSO2��bmolNO��Ӧ��ֱ�����Na2S2O4��NH4NO3 �� SԪ�ػ��ϼ���+4�۽��͵�+3�ۣ�NԪ�ػ��ϼ���+2�����ߵ�+5�ۣ���ͨ��xmol������
�ɻ��ϼ�����������ȿ�֪4x+a=3b��x= ![]() �������������Ϊ
�������������Ϊ ![]() mol��22.4L/mol=5.6��3b��a��L�����Դ��ǣ�5.6��3b��a����
mol��22.4L/mol=5.6��3b��a��L�����Դ��ǣ�5.6��3b��a����

����Ŀ�����ȷ�Ӧԭ������Ӧ���������ϣ����纸�Ӹֹ졢ұ�����۽�����������ͳ���̻���ȡ�ijС��ͬѧ���о����ȷ�Ӧʱ�������������ۺ�ʵ�顣
��1���������ȷ�Ӧ������������ʶ��������ȷ����___________������ĸ������
a .�÷�Ӧ���ڸ����·��������Ը÷�Ӧ����
b.��Ϊ���Ļ�ԭ�Խ�ǿ���������ܽ���Բ����õĽ������仯�������û�����
��2��������������Ӧ�Ļ�ѧ����ʽ��______________________________________��
��3��������������Ӧ���ù���ɷֵij���ȷ����
ʵ����� | ���������� |
i | ȡ����������Ʒ���������ϡ���ᣬ�����ܽ⣬������ɫ������������ΪH2������Һ��dz��ɫ |
ii | ��i������Һ�м�������KSCN��Һ����Һ��dz��ɫ���ټ���H2O2��Һ��������ɫ������������ΪO2������Һ��Ϊ���ɫ |
��������ʵ���֪����Һ��FeԪ�صĴ�����ʽ��______________________��
��i�в���H2��ԭ������Ʒ�г���Fe�⣬������δ��Ӧ��Al��Ϊ������Ʒ���Ƿ�Al���ʣ���ѡ�õ��Լ���_________________________________��
��ii������O2�Ļ�ѧ����ʽ��______________________________����һ����ʵ�����������������Ʒ��FeԪ�صĴ�����ʽ��Fe��Fe2O3��Fe3O4