题目内容
【题目】氯化亚砜(SOCl2)为无色或浅黄色发烟液体,易挥发,遇水反应,其制取过程的相关反应如下:S(s)+Cl2(g) ![]() SCl2(l) (Ⅰ)
SCl2(l) (Ⅰ)
SCl2(l)+SO3(l)═SOCl2(l)+SO2(g)(Ⅱ)
已知二氯化硫(SCl2)熔点﹣78°C,沸点59°C,如图是实验室由氯气与硫合成二氯化硫的装置.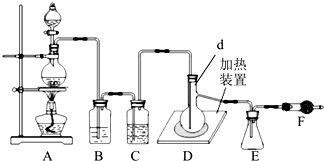
(1)仪器组装完成后,检查装置气密性的操作是;反应前要先排尽系统中空气,此做法目的是 .
(2)装置D中玻璃仪器d的名称是 , 向其中放入一定量的硫粉,加热使之融化,轻轻摇动使硫附着在容器的内壁,形成一薄层膜,这样做的优点是 .
(3)实验时,为防止E中液体挥发,可采取的措施是 . 装置F(盛放碱石灰)的作用是 , .
(4)工业上以硫黄、液氯和液体三氧化硫为原料,能生产高纯度(99%以上)氯化亚砜,为使原子的利用率达到100%,三者的物质的量比为;已知:SOCl2+4NaOH═Na2SO3+2NaCl+2H2O.
供选择的试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸银溶液、品红溶液请设计简单的实验来验证氯化亚砜与水完全反应的产物,简要说明实验操作、现象和结论 .
【答案】
(1)关闭分液漏斗活塞,在干燥管末端连接一个排尽空气的气球,对A中烧瓶微热,若气球膨大,停止加热,气球恢复原状,说明装置气密性良好;防止加热硫粉时,空气中的氧气与硫粉反应
(2)蒸馏烧瓶;增大反应物接触面积(或使反应更加充分)
(3)将锥形瓶放入冰水中冷却(冷水浴或冰水浴);一是防止空气中水蒸气进入;二是吸收多余的氯气
(4)1:1:1;分别取两份水解后的溶液于试管中,向其中一支试管中加入品红溶液,品红褪色,说明有二氧化硫生成;向另一支试管中加入硝酸银溶液,生成白色沉淀,说明有HCl生成
【解析】解:装置A制备氯气,装置B吸收氯气的中HCl,装置C干燥氯气,D装置生成SCl2 , E装置收集SCl2 , F装置吸收多余的氯气,吸收空气中水蒸气,防止进入E中,(1)仪器组装完成后,检查装置气密性的操作是:(关闭分液漏斗活塞) 在干燥管末端连接一个排尽空气的气球,对A中烧瓶微热,若气球膨大,停止加热,气球恢复原状,说明装置气密性良好;加热硫粉时,空气中的氧气与硫粉反应,应先排尽系统中空气,所以答案是:关闭分液漏斗活塞,在干燥管末端连接一个排尽空气的气球,对A中烧瓶微热,若气球膨大,停止加热,气球恢复原状,说明装置气密性良好;防止加热硫粉时,空气中的氧气与硫粉反应;(2)根据装置图可知装置D中玻璃仪器的名称为蒸馏烧瓶,热使之融化,轻轻摇动使硫附着在容器的内壁,形成一薄层膜,可以增大反应物接触面积,使反应更加充分,所以答案是:蒸馏烧瓶; 增大反应物接触面积(或使反应更加充分);(3)二氯化硫(SCl2)的沸点低,为防止SCl2中液体挥发,可采取将锥形瓶放入冰水中冷却等措施,装置F(盛放碱石灰)有两个作用:一是防止空气中水蒸气进入;二是吸收多余的氯气,所以答案是将锥形瓶放入冰水中冷却(冷水浴或冰水浴);一是防止空气中水蒸气进入;二是吸收多余的氯气;(4)由S(s)+Cl2(g) ![]() SCl2(l)、SCl2(l)+SO3(l)═SOCl2(l)+SO2(g)可知硫黄、液氯和液体三氧化硫的物质的量之比为1:1:1; 由SOCl2与氢氧化钠溶液反应可知,SOCl2水解后分解得到SO2、HCl,利用品红溶液检验有二氧化硫生成,用硝酸银溶液检验氯离子,具体实验操作为:分别取两份水解后的溶液于试管中,向其中一支试管中加入品红溶液,品红褪色,说明有二氧化硫生成;向另一支试管中加入硝酸银溶液,生成白色沉淀,说明有HCl生成,所以答案是:1:1:1;分别取两份水解后的溶液于试管中,向其中一支试管中加入品红溶液,品红褪色,说明有二氧化硫生成;向另一支试管中加入硝酸银溶液,生成白色沉淀,说明有HCl生成.
SCl2(l)、SCl2(l)+SO3(l)═SOCl2(l)+SO2(g)可知硫黄、液氯和液体三氧化硫的物质的量之比为1:1:1; 由SOCl2与氢氧化钠溶液反应可知,SOCl2水解后分解得到SO2、HCl,利用品红溶液检验有二氧化硫生成,用硝酸银溶液检验氯离子,具体实验操作为:分别取两份水解后的溶液于试管中,向其中一支试管中加入品红溶液,品红褪色,说明有二氧化硫生成;向另一支试管中加入硝酸银溶液,生成白色沉淀,说明有HCl生成,所以答案是:1:1:1;分别取两份水解后的溶液于试管中,向其中一支试管中加入品红溶液,品红褪色,说明有二氧化硫生成;向另一支试管中加入硝酸银溶液,生成白色沉淀,说明有HCl生成.

 阅读快车系列答案
阅读快车系列答案【题目】铝热反应原理可以应用在生产上,例如焊接钢轨、冶炼难熔金属、制作传统的烟火剂等。某小组同学在研究铝热反应时,进行如下讨论和实验。
(1)关于铝热反应有以下两种认识,其中正确的是___________(填字母号)。
a .该反应需在高温下发生,所以该反应吸热
b.因为铝的还原性较强,所以铝能将相对不活泼的金属从其化合物中置换出来
(2)铝和氧化铁反应的化学方程式是______________________________________。
(3)铝和氧化铁反应所得固体成分的初步确定。
实验序号 | 操作及现象 |
i | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
ii | 向i所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液,产生无色气体(经检验为O2),溶液变为深红色 |
①由上述实验可知:溶液中Fe元素的存在形式有______________________。
②i中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,可选用的试剂是_________________________________。
③ii中生成O2的化学方程式是______________________________。进一步的实验表明,上述固体样品中Fe元素的存在形式有Fe、Fe2O3、Fe3O4