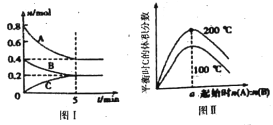
题目内容
【题目】(1)配平该方程式__KMnO4+__HCl (浓) =__KCl+__MnCl2+__Cl2↑+__H2O
(2)反应中(1)中____是还原剂,_____是还原产物 .
(3)该反应的离子方程式为:_______________________
(4)用双线桥法分析此氧化还原反应____________________________
(5)NA表示阿伏伽德罗常数,若产生标准状况下的气体的体积为2.24L ,则反应过程中转移电子的数目为_________,被氧化的HCl的质量为_____g
【答案】2 16 2 2 5 8 HCl MnCl2. 2MnO4- +16H+ +10Cl- =2Mn2+ +5Cl2↑+8H2O 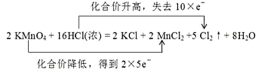 0.2NA 7.3
0.2NA 7.3
【解析】
在2KMnO4+16HCl (浓) =2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素的化合价降低,Cl元素的化合价升高,在离子反应中,气体和水应保留化学式,并根据化合价的变化判断转移的电子数,以此来解答。
(1)反应中KMnO4→MnCl2,锰元素中由+7价降低到+2价,降低了5价;2HCl→Cl2,氯元素由-1价升高到0价,生成了氯气,化合价升高了2价,根据氧化还原反应中化合价升降总数相等规律可知,KMnO4填系数2,Cl2填系数5,然后根据原子守恒配平其它物质的系数,具体如下:2KMnO4+16HCl (浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
综上所述,本题答案是:2 ,16,2,2,5, 8。
(2)反应中(1)中氯元素的化合价升高,HCl做还原剂;反应中Mn元素的化合价降低,还原产物为MnCl2;
综上所述,本题答案是:HCl,MnCl2。
(3)在离子反应中,气体和水应保留化学式,该反应的离子反应为2MnO4- +16H+ +10Cl- =2Mn2+ +5Cl2↑+8H2O;
综上所述,本题答案是:2MnO4- +16H+ +10Cl- =2Mn2+ +5Cl2↑+8H2O。
(4)该反应中Mn得到2×5e-,Cl失去10e-,则双线桥法表示反应转移的电子的方向和数目为: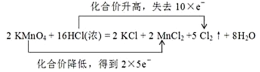 ;
;
综上所述,本题答案是: 。
。
(5)产生标准状况下的气体的体积为2.24L,物质的量为0.1mol;根据反应关系:10e---5Cl2,若生成0.1mol氯气,则反应过程中转移电子的数目为0.2NA;根据10e--10HCl(被氧化)-5Cl2关系,若生成0.1mol氯气,被氧化的HCl的物质的量为0.2mol;其质量为0.2mol×36.5=7.3g;
综上所述,本题答案是:0.2NA;7.3。

【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
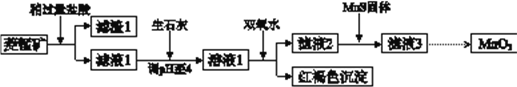
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_________。盐酸溶解MnCO3的化学方程式是_________。
(2)向溶液1中加入双氧水时,反应的离子方程式是___________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是__________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。用酸化的NaClO3溶液将MnCl2氧化生成MnO2和Cl2,该反应的离子方程式为___________。
(5)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是___________。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是_________。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是_________。