题目内容
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+ yB(g)![]() zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
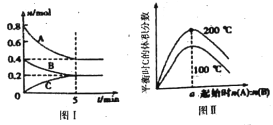
A. 图II所知反应xA(g)+yB(g) ![]() zC(g) △H<0,且a=2
zC(g) △H<0,且a=2
B. 200℃时,该反应的平衡常数为25
C. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol/(Lmin)
D. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
【答案】B
【解析】A项,由图II可知:升高温度,平衡时C的体积分数增大,说明升高温度化学平衡向正反应方向移动,又因为升高温度,化学平衡向吸热方向移动,所以正反应为吸热反应,△H>0;根据图Ⅰ数据可知该反应的化学方程式为2A+B![]() C,只有当两种反应物按方程式的计量数之比加入时,达到平衡时生成物C的体积分数才最高,所以a=2,综上分析,A错误。B项,由图Ⅰ可得,200℃,平衡时c(A)=0.4mol÷2L=0.2mol/L,c(B)=c(C)=0.2mol÷2L=0.1mol/L,由前面的分析化学方程式为2A+B
C,只有当两种反应物按方程式的计量数之比加入时,达到平衡时生成物C的体积分数才最高,所以a=2,综上分析,A错误。B项,由图Ⅰ可得,200℃,平衡时c(A)=0.4mol÷2L=0.2mol/L,c(B)=c(C)=0.2mol÷2L=0.1mol/L,由前面的分析化学方程式为2A+B![]() C,所以200℃时,该反应的平衡常数为:K=
C,所以200℃时,该反应的平衡常数为:K=![]() =25,故B正确。C项,200℃时,反应从开始到平衡的平均速率v(B)=(0.4-0.2)mol÷2L÷5min=0.02mol/(Lmin),故C错误。D项,当外界条件由200℃降温到100℃,平衡常数K一定变化,原平衡一定被破坏,正逆反应速率均减小,故D错误。
=25,故B正确。C项,200℃时,反应从开始到平衡的平均速率v(B)=(0.4-0.2)mol÷2L÷5min=0.02mol/(Lmin),故C错误。D项,当外界条件由200℃降温到100℃,平衡常数K一定变化,原平衡一定被破坏,正逆反应速率均减小,故D错误。

【题目】已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | K=1.77×10-4 | K=5.0×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列叙述错误的是
A. NaCN溶液中通人少量CO2发生的离子反应为:CN-+H2O+CO2=HCN+HCO3-
B. 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含阴离子总数前者大于后者
C. 等物质的量浓度的NaHCO3和Na2CO3混合溶液中:c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
D. 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者