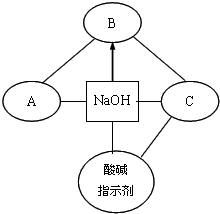
题目内容
1.下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是( )| A. | 盐酸和NaOH溶液混合 | B. | 氯化氢溶于水 | ||
| C. | 溴化氢气体与氨气相遇反应 | D. | 锌和稀硫酸反应 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,结合发生的反应判断共价键的断裂、离子键的形成,以此来解答.
解答 解:A.反应生成氯化钠和水,没有共价键的破坏,故A不选;
B.氯化氢溶于水发生电离,只有共价键的破坏,故B不选;
C.溴化氢气体与氨气相遇反应,反应生成氯化铵,HBr中共价键破坏,生成溴化铵时有离子键形成,故C选;
D.反应生成硫酸锌和氢气,没有共价键的破坏,故D不选;
故选C.
点评 本题考查化学键,为高频考点,把握化学键形成的一般规律及化学键的类型为解答的关键,注意分析与应用能力的考查,注意化学反应中化学键断裂和生成,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.某元素原子R的原子核外有16个电子,质量数为34,则原子核里的中子数为( )
| A. | 32 | B. | 20 | C. | 16 | D. | 18 |
9.有如下4种碳骨架的烃,其中 表示碳原子,
表示碳原子, 表示碳碳单键,未画出的键表示碳原子与氢原子相连,则下列说法正确的是( )
表示碳碳单键,未画出的键表示碳原子与氢原子相连,则下列说法正确的是( )
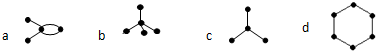
 表示碳原子,
表示碳原子, 表示碳碳单键,未画出的键表示碳原子与氢原子相连,则下列说法正确的是( )
表示碳碳单键,未画出的键表示碳原子与氢原子相连,则下列说法正确的是( )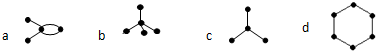
| A. | a和c互为同分异构体 | B. | b能使酸性高锰酸钾溶液褪色 | ||
| C. | b和c互为同系物 | D. | 常温下d为气体 |
16.下列说法正确的是( )
| A. | 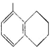 所有碳原子可能在同一平面上 所有碳原子可能在同一平面上 | |
| B. | 化合物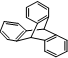 是苯的同系物 是苯的同系物 | |
| C. | 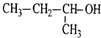 的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 | |
| D. | 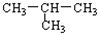 与CH3-CH2-CH2-CH3互为同分异构体 与CH3-CH2-CH2-CH3互为同分异构体 |
6.在密闭容器中进行X2(g)+4Y2(g)?2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol•L-1、0.4mol•L-1、0.4mol•L-1、0.3mol•L-1,当反应到某时刻时,各物质的浓度不可能是( )
| A. | c(X2)=0.15 mol•L-1 | B. | c(Y2)=0.7 mol•L-1 | ||
| C. | c(Y2)=0.3 mol•L-1 | D. | c(Q2)=0.6 mol•L-1 |
13.现有含NaCl、Na2SO4 和NaNO3 的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl- 和NO3- 的相互分离.相应的实验过程如下:
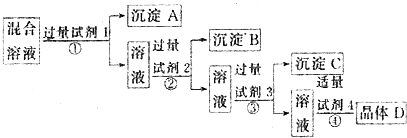
下列关于四种试剂顺序正确的是( )

下列关于四种试剂顺序正确的是( )
| A. | 氯化钡溶液、硝酸银溶液、碳酸钠溶液、硝酸溶液 | |
| B. | 硝酸银溶液、氯化钡溶液、碳酸钠溶液、硝酸溶液 | |
| C. | 氯化钡溶液、硝酸银溶液、硝酸溶液、碳酸钠溶液 | |
| D. | 硝酸银溶液、碳酸钠溶液、氯化钡溶液、硝酸溶液 |
10.NA表示阿伏加德罗常数的值.下列判断中,正确的是( )
| A. | H2O2溶液中加入MnO2可制得O2,产生2.24L(标况)O2,转移0.4NA个电子 | |
| B. | SO2和CO2都属于酸性氧化物,Na2O和A12O3都属于碱性氧化物 | |
| C. | 在氯化铵水溶液中,既存在水解平衡,又存在电离平衡 | |
| D. | O2在放电的条件下生成O3属于化学变化,电解质溶液导电属于物理变化 |
11.某未知溶液可能含Cl-、SO32-、Na+、SO42-、Al3+,将溶液滴在红色石蕊试纸上,试纸变蓝.取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀.下列判断合理的是( )
| A. | 一定有Cl- | B. | 一定有SO42- | C. | 一定没有Al3+ | D. | 一定没有SO32- |