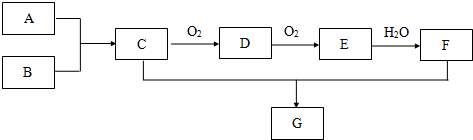
题目内容
1.下列各组离子能在溶液中大量共存的是( )| A. | HCO3-、Na+、OH-、K+ | B. | Cl-、NO3-、Fe2+、H+ | ||
| C. | Ba2+、OH-、Cl-、Na+ | D. | NH4+、Na+、NO3-、OH- |
分析 A.碳酸氢根离子与氢氧根离子反应;
B.硝酸根离子在酸性条件下能够氧化亚铁离子;
C.四种离子之间不发生反应,能够大量共存;
D.铵根离子与氢氧根离子反应生成一水合氨.
解答 解:A.HCO3-、OH-之间发生反应生成碳酸根离子和水,在溶液中不能大量共存,故A错误;
B.NO3-、Fe2+、H+之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.Ba2+、OH-、Cl-、Na+之间不反应,在溶液中能够大量共存,故C正确;
D.NH4+、OH-之间反应生成一水合氨,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,该题是高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识的能力.

练习册系列答案
相关题目
2.下列物质属于非电解质的是( )
| A. | 铜 | B. | 硫酸钡 | C. | 蔗糖 | D. | 醋酸 |
7.已知常温下在溶液中可以发生如下两个离子反应:
Ce4++Fe2+→Fe3++Ce3+
Sn2++2Fe3+→2Fe2++Sn4+,
由此可以确定Ce4+、Ce3+、Fe3+三种离子的氧化性由强到弱的顺序( )
Ce4++Fe2+→Fe3++Ce3+
Sn2++2Fe3+→2Fe2++Sn4+,
由此可以确定Ce4+、Ce3+、Fe3+三种离子的氧化性由强到弱的顺序( )
| A. | Ce4+、Ce3+、Fe3+ | B. | Ce4+、Fe3+、Ce3+ | C. | Fe3+、Ce4+、Ce3+ | D. | Ce3+、Ce4+、Fe3+ |
6.下列排列顺序不正确的是( )
| A. | 热稳定性:HF>HCl>HBr | B. | 碱性:Ca(OH)2>Mg(OH)2 | ||
| C. | 元素金属性:Na>Mg>Al | D. | 酸性:H3PO4>H2SO4>HClO4 |
13.下列化学用语正确的是( )
| A. | Na2S2中硫元素的化合价为-2 | B. | NH4Cl的电子式: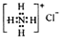 | ||
| C. | S2-的结构示意图: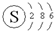 | D. | COCl2的电子式: |
10.下列离子方程式正确的是( )
| A. | 向氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| C. | Fe(NO3)3 溶液中加入过量HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | 碳酸氢铵溶液中加入足量NaOH溶液:NH4++HCO3-+2OH-═CO32-+NH3•H2O+H2O |