题目内容
11.同温同压下,若A容器中充满O2,B容器中充满O3,(1)若所含分子总数相等,则A中O2和B 中O3的体积比是1:1
(2)若两容器中所含原子总数相等,则A中O2和B中O3的体积比是3:2
(3)若两容器的容积比为3:2,则,质量之比为1:1,
(4)同温同压下,O2和O3密度之比为2:3
(5)同温同压下,某C容器充满O2和O3的混合物,经测定混合气体对H2的相对密度是20,则混合物中O2和O3体积比为1:1
(6)等质量的O2与O2和O3的混合物中的氧原子个数之比为1:1.
分析 (1)同温同压下,根据n=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$计算;
(2)根据分子的组成判断气体物质的量的关系,根据n=$\frac{V}{Vm}$计算;
(3)根据n=$\frac{V}{Vm}$计算物质的量,根据m=nM计算质量;
(4)根据$ρ=\frac{m}{V}$计算密度;
(5)根据十字交叉法计算体积之比;
(6)根据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$计算.
解答 解:(1)同温同压下,气体的Vm相等,根据n=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$可知:气体的分子数之比等于气体的体积之比,即为1:1;故答案为:1:1;
(2)若两容器中所含原子总数相等,则根据分子组成可知,两容器中的分子数之比等于3:2,根据n=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$可知:气体的分子数之比等于气体的体积之比,为3:2,故答案为:3:2;
(3)若两容器的体积比为3:2,根据n=$\frac{V}{Vm}$可知O2和O3物质的量之比为3:2,质量之比为:3mol×32g/mol:2mol×48g/mol=1:1,故答案为:1:1;
(4)根据$ρ=\frac{m}{V}$计算,密度之比为:$\frac{1}{3}$:$\frac{1}{2}$=2:3,故答案为:2:3;
(5)混合气体对H2的相对密度是20,所以两种气体的平均相对分子质量是40,根据十字交叉法:两种气体的体积之比是:(40-32):(48-40)=1:1,故答案为:1:1;
(6)等质量(设为m)的O2与O2和O3的混合物中的氧原子个数之比为($\frac{m}{32}×2$):($\frac{m}{48×3}$)=1:1,故答案为:1:1.
点评 本题考查阿伏加德罗定律及推论的应用,题目难度不大,注意物质的量的有关计算公式的运用.

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案| A. | HCO3-、Na+、OH-、K+ | B. | Cl-、NO3-、Fe2+、H+ | ||
| C. | Ba2+、OH-、Cl-、Na+ | D. | NH4+、Na+、NO3-、OH- |
| A. | 棉花 | B. | 塑料 | C. | 蚕丝 | D. | 羊毛 |
①Al ②Al2O3③AlCl3 ④Al(OH)3.
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②④ |
①苯燃烧时发生明亮并带有浓烟的火焰
②苯在特定条件下能与氢气发生加成反应
③苯不与酸性高锰酸钾溶液或溴水发生反应
④苯分子具有平面正六边形结构,其中6个碳原子之间的键完全相同.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |

| A. | 该电池的正极为锌 | |
| B. | 该电池反应中二氧化锰起催化剂作用 | |
| C. | 当0.1molZn完全溶解时,流经电解质溶液的电子个数为1.204×1023 | |
| D. | 电池正极反应式为:2MnO2+2e-+2H2O═2MnO(OH)+2OH- |
| A. | 乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH-$\stackrel{△}{→}$CH3COO-+CH3CH2O-+H2O | |
| B. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| D. | 乙醛溶液与新制氢氧化铜碱性悬浊液共热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$ CH3COO-+Cu2O↓+3H2O |
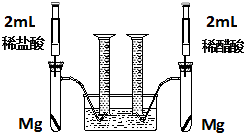 某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图:
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案.装置如图: