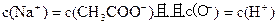题目内容
25℃时,在20mL0.1mol·L-1的氢氧化钠溶液中,逐滴加入0.2 mol·L-1 CH3COOH,溶液pH的变化曲线如图所示,有关粒子浓度关系的比较不正确的是 ( )
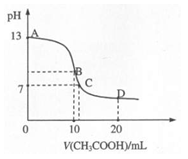
A.B点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.C点:c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
C.D点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.对曲线上A、B间任何一点,溶液中都有:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)

A.B点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.C点:c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
C.D点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.对曲线上A、B间任何一点,溶液中都有:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D
A:酸碱恰好中和生成CH3COONa溶液,由于CH3COO-水解,使溶液呈碱性,正确
B:中性溶液,c(H+)=c(OH-),依据电荷守恒可知另两离子为溶液中的主要离子,浓度必然也相同:c(CH3COO-)=c(Na+)>c(H+)=c(OH-),正确
C:由物料守恒可知,正确
D:当刚刚加入醋酸时,c(CH3COO-)不可能大于c(OH-),不正确
答案为D
B:中性溶液,c(H+)=c(OH-),依据电荷守恒可知另两离子为溶液中的主要离子,浓度必然也相同:c(CH3COO-)=c(Na+)>c(H+)=c(OH-),正确
C:由物料守恒可知,正确
D:当刚刚加入醋酸时,c(CH3COO-)不可能大于c(OH-),不正确
答案为D

练习册系列答案
相关题目
 S2-+H3O+
S2-+H3O+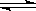 H2CO3+2OH-
H2CO3+2OH- 度
度 四种离子,其浓度大小有如下关系
四种离子,其浓度大小有如下关系