题目内容
将等体积的0.1 mol·L-1 KHSO4溶液逐滴加入0.1 mol·L-1的Na2SO3溶液中,所得溶液能使紫色石蕊试液变红,则下列各离子浓度关系中不正确的是
| A.c(SO)>c(SO)>c(H+)>c(OH-) |
| B.c(Na+)>c(K+)>c(H+)>c(OH-) |
| C.c(Na+)=c(SO)+c(H2SO3)+c(HSO)+c(SO) |
| D.c(Na+)+c(K+)+c(H+)=2c(SO)+c(HSO)+c(OH-) +2c(SO) |
A
H++SO32-=HSO3-,恰好完全反应,此时是0.1molSO42-和0.1molHSO3-的溶液,因为所得溶液能使紫色石蕊试液变红,溶液显酸性,HSO3-的电离程度大于水解程度,
A.错误,应为:c(SO)>c(H+)>c(SO)>c(OH-)
B 正确,由题意可知,钠离子浓度为0。2 mol·L-1,价钾离子浓度为0.1 mol·L-1,溶液显酸性,氢离子浓度大于氢氧根离子浓度
C正确,遵循物料守恒c(SO)+c(H2SO3)+c(HSO)="0.1" mol·L-1,c(SO)="0.1" mol·L-1,
c(Na+)="0.2" mol·L-1
D 正确,遵循质子守恒。
A.错误,应为:c(SO)>c(H+)>c(SO)>c(OH-)
B 正确,由题意可知,钠离子浓度为0。2 mol·L-1,价钾离子浓度为0.1 mol·L-1,溶液显酸性,氢离子浓度大于氢氧根离子浓度
C正确,遵循物料守恒c(SO)+c(H2SO3)+c(HSO)="0.1" mol·L-1,c(SO)="0.1" mol·L-1,
c(Na+)="0.2" mol·L-1
D 正确,遵循质子守恒。

练习册系列答案
相关题目

 )= 。
)= 。 (HCO3-)+c(CO32-)
(HCO3-)+c(CO32-)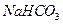 、
、 、
、 、
、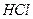
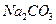 、
、 、
、
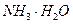 、
、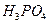 、
、 、
、