题目内容
【题目】科研人员最近发明了一种水电池,这种电池能利用淡水和海水之间的含盐量差进行供电,该电池的化学反应为:5MnO2+2Ag+2NaCl→Na2Mn5O10+2AgCl
(1)简述Na2O熔点比NaCl高的其原因。_______________________
(2)将Al粉和MnO2混合,经高温引发反生反应,写出化学反应方程式。__________________________,若反应中生成5.5kg单质,则转移电子的数目是________个。
(3)元素周期表中,铁(Fe)和锰(Mn)位于同周期。向化合物X的溶液中,滴加NaOH溶液时,发生反应:X+3NaOH→3Y+Fe(OH)3↓。X的化学式可能是________________、________________。
(4)将SO2通入Fe2(SO4)3溶液中,溶液变为浅绿色,且酸性增强,请写出离子方程式。______________________
【答案】O2-电荷比Cl-多,离子半径小,Na2O中离子键比NaCl强,故Na2O中熔点高 2Al+3MnO2 ![]() Al2O3+3Mn 400NA Fe(NO3)3 FeCl3 2Fe3++SO32-+2H2O→2Fe2++SO42-+4H+
Al2O3+3Mn 400NA Fe(NO3)3 FeCl3 2Fe3++SO32-+2H2O→2Fe2++SO42-+4H+
【解析】
(1)Na2O和NaCl都是离子晶体,用晶格能大小解释Na2O熔点比NaCl高的原因: O2-电荷比Cl-多,离子半径小,Na2O中离子键比NaCl强,故Na2O中熔点高;
(2)将Al粉和MnO2混合,经高温引发反生反应,生成锰和三氧化二铝,化学反应方程式 2Al+3MnO2 ![]() Al2O3+3Mn,若反应中生成5.5kg单质,n(Mn)=5.5×103g/55g·mol-1=100mol,则转移电子的数目是400NA个。
Al2O3+3Mn,若反应中生成5.5kg单质,n(Mn)=5.5×103g/55g·mol-1=100mol,则转移电子的数目是400NA个。
(3)元素周期表中,铁(Fe)和锰(Mn)位于同周期。向化合物X的溶液中,滴加NaOH溶液时,发生反应:X+3NaOH→3Y+Fe(OH)3↓。X为铁离子的一元酸盐,X的化学式可能是 Fe(NO3)3、FeCl3 。
(4)铁离子具有氧化性,将SO2通入Fe2(SO4)3溶液中,溶液变为浅绿色,且酸性增强,离子方程式2Fe3++SO32-+2H2O=2Fe2++SO42-+4H+。

【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
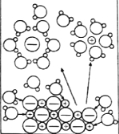
NaCl溶于水 |
电解CuCl2溶液 |
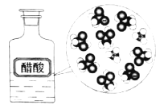
CH3COOH在水中电离 |
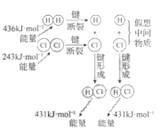
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D