题目内容
【题目】联氨(N2H4)可以用于处理高压锅炉水中的氧,防止锅炉被腐蚀,其中一种可能的反应机理如图所示。回答下列问题:
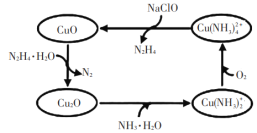
(1)1 mol N2H4·H2O含σ键的数目为______。
(2)Cu2O与NH3·H2O反应能形成较稳定的![]() 的原因是____。
的原因是____。
(3)N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃),沸点(114℃)分别远远高于O2的熔点(218℃),沸点(183℃),原因是____。
(4)NaClO发生水解可生成HClO,HClO的空间构型是___,中心原子的杂化类型是___。
【答案】7NA NH3H2O中NH3的N原子提供孤对电子,与Cu+的空轨道形成配位键 N2H4分子之间存在氢键,O2分子之间为范德华力,氢键比较范德华力更强 V形 sp3
【解析】
(1)根据N2H4·H2O成键原理进行分析;
(2)根据形成![]() 的结构特点进行判断;
的结构特点进行判断;
(3)根据氢键比较范德华力更强的性质进行解答;
(4)根据杂化轨道理论进行分析解答;
(1)N2H4·H2O分子含有1个N- N键、4个N-H键、2个O-H键,分子共含有7个σ键,所以1 molN2H4·H2O含σ键的数目为7NA,故答案:7NA;
(2)Cu2O与NH3·H2O反应能形成较稳定的![]() 的原因是:NH3·H2O中NH3的N原子提供孤对电子与Cu+的空轨道形成配位键,故答案:NH3H2O中NH3的N原子提供孤对电子,与Cu+的空轨道形成配位键;
的原因是:NH3·H2O中NH3的N原子提供孤对电子与Cu+的空轨道形成配位键,故答案:NH3H2O中NH3的N原子提供孤对电子,与Cu+的空轨道形成配位键;
(3)因为N2H4分子之间存在氢键,O2分子之间为范德华力,氢键比较范德华力更强,所以N2H4与O2的相对分子质量相近,但N2H4的熔点(2℃),沸点(114℃)分别远远高于O2的熔点(218℃),沸点(183℃),故答案: N2H4分子之间存在氢键,O2分子之间为范德华力,氢键比较范德华力更强;
(4)HClO的中心原子O原子孤电子对数=![]() =2,价层电子对数=2+2=4,HClO的空间构型为V形,O原子采取sp3杂化,故答案为:V形;sp3。
=2,价层电子对数=2+2=4,HClO的空间构型为V形,O原子采取sp3杂化,故答案为:V形;sp3。

 阅读快车系列答案
阅读快车系列答案