题目内容
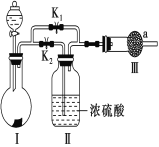
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为 11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如下图所示:
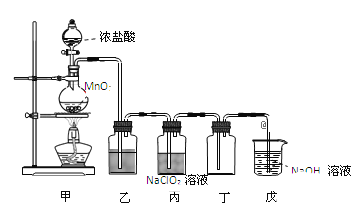
(1)甲装置中圆底烧瓶内发生反应的化学方程式是_________________________________________。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:
①____________________________________________(用化学方程式表示),
②HClO + HCl + 2NaClO2 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。戊装置的作用是_______________________。
(4)戊装置烧杯中 NaOH 溶液吸收 ClO2后,生成了 ClO![]() 、ClO
、ClO![]() ,该反应的离子方程式是_______________________________________。
,该反应的离子方程式是_______________________________________。
【答案】4HCl(浓)+2MnO2![]() MnCl2+Cl2↑+2H2O Cl2 + H2O
MnCl2+Cl2↑+2H2O Cl2 + H2O![]() HClO + HCl 饱和食盐水 吸收未反应完的氯气和二氧化氯,防止污染环境 2ClO2 + 2OH- == ClO
HClO + HCl 饱和食盐水 吸收未反应完的氯气和二氧化氯,防止污染环境 2ClO2 + 2OH- == ClO![]() + ClO
+ ClO![]() + H2O
+ H2O
【解析】
(1)甲装置中二氧化锰与浓盐酸在加热条件下反应生成MnCl2、Cl2和H2O;
(2)由第②步反应中反应物可知,第①步是氯气与水反应生成HCl和HClO;
(3)由题干信息可知,装置乙的作用是除Cl2中HCl,分析乙装置内液体;装置戊的作用是吸收尾气;
(4)NaOH溶液吸收ClO2后,生成了ClO2-、ClO3-,根据化合价升降守恒、电荷守恒、原子守恒配平。
(1)甲装置中二氧化锰与浓盐酸在加热条件下反应生成MnCl2、Cl2和H2O,反应方程式为:4HCl(浓)+2MnO2![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)由第②步反应中反应物可知,第①步是氯气与水反应生成HCl和HClO,反应方程式为:Cl2 + H2O![]() HClO + HCl;
HClO + HCl;
(3)Clˉ存在时会催化ClO2的生成,若无乙装置,则丙装置内产生ClO2的速率明显加快导致ClO2浓度过高,易发生分解甚至爆炸,故装置乙的作用是除Cl2中HCl,可选用试剂为饱和食盐水;氯气和二氧化氯均为有毒气体,不能直接排放至空气中,因此需要进行尾气处理,故装置丙的作用是:吸收未反应完的氯气和二氧化氯,防止污染环境;
(4)NaOH溶液吸收ClO2后,生成了ClO2-、ClO3-,ClO2被氧化为ClO3-(化合价升高1),ClO2同时被还原为ClO2-(化合价降低1),根据化合价升降守恒和电荷守恒、原子守恒配平可得其反应的离子方程式:2ClO2 + 2OH- ==ClO2-+ClO3-+H2O

 53随堂测系列答案
53随堂测系列答案