��Ŀ����
����Ŀ�������G���ĺϳ�·����ͼ��

��֪��CH3(CH2)4Br![]() CH3(CH2)3CH2MgBr
CH3(CH2)3CH2MgBr
��1��G�������ĺ�����������___��___��д���������ƣ���
��2��C��D�ķ�Ӧ������___���ڿ����о��ã�A���ɰ�ɫת��Ϊ�Ȼ�ɫ����ԭ����___��
��3��д����������������A��һ��ͬ���칹��Ľṹ��ʽ��___��ֻдһ�֣���
���ܷ���������Ӧ����FeCl3��Һ�ܷ�����ɫ��Ӧ���ڳ������⣬����3�ֲ�ͬ�Ĺ����ţ��۸÷��Ӻ˴Ź���������5�ֲ�ͬ�ķ壬�ҷ�ֵ��Ϊ1��1��2��2��2��
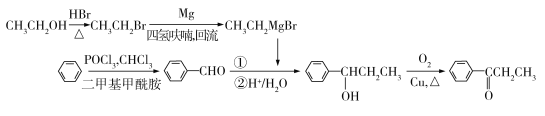
��4��д���Ա����Ҵ�������������Ϊԭ���Ʊ�����ͪ��![]() ���ĺϳ�·������ͼ�����Լ����л��ܼ����ã��ϳ�·������ͼʾ����������ɣ���___��
���ĺϳ�·������ͼ�����Լ����л��ܼ����ã��ϳ�·������ͼʾ����������ɣ���___��
���𰸡��Ѽ� ���� ȡ����Ӧ A�������е�O2���� ![]() ��
��![]() ������������
������������ 
��������
��1������G�Ľṹ��ʽ�����������������ƣ�
��2������C��D�Ľṹ��ʽ��C��D�ķ�Ӧ��C����ԭ�ӱ���OCH3���棻�λ��ϵ��ǻ��ױ�������
��3��A��ͬ���칹����ܷ���������Ӧ��˵������ȩ������FeCl3��Һ�ܷ�����ɫ��Ӧ˵�����з��ǻ����ڳ������⣬����3�ֲ�ͬ�Ĺ����ţ����ݲ����Ͷȣ�����3�ֲ�ͬ�Ĺ�������ȩ�����ǻ���̼̼�������۸÷��Ӻ˴Ź���������5�ֲ�ͬ�ķ壬�ҷ�ֵ��Ϊ1��1��2��2��2��˵���ṹ�Գƣ�
��4���Ҵ����廯�ⷢ��ȡ����Ӧ���������飬���CH3(CH2)4Br![]() CH3(CH2)3CH2MgBr��֪��
CH3(CH2)3CH2MgBr��֪��![]() �� ���ݸ���D��E��
�� ���ݸ���D��E�� 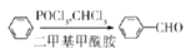 ������ȩ��
������ȩ��![]() ��Ӧ����
��Ӧ����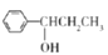 ��
�� ��������
�������� ��
��
(1)����G�Ľṹ��ʽ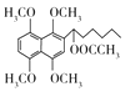 ��G�к������������Ѽ����������ʴ�Ϊ���Ѽ���������
��G�к������������Ѽ����������ʴ�Ϊ���Ѽ���������
(2)�Ա�C��D�Ľṹ����֪����OCH3ȡ����Br������ȡ����Ӧ��A�ṹ�뱽�����ƣ�����Ӧ�þ������Ƶ����ʣ�Ҳ�ױ������������������ʴ�Ϊ��ȡ����Ӧ��A�������е�O2������
(3)A�ķ���ʽΪC10H8O2�����ܷ���������Ӧ��˵����ȩ��������FeCl3��Һ�ܷ�����ɫ��Ӧ��˵�����з��ǻ���������3�ֲ�ͬ�Ĺ����������ݷ���ʽ��֪����C��C�������˴Ź�������ֵ��Ϊ1��1��2��2��2��˵���������������⣬���ҷֱ�Ϊ�����������ǶԳƽṹ������ֻ��������λȡ�������ṹ������ͼ��![]() ��
��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��
(4)�Ա�ԭ����Ŀ�����Ľṹ������Ҫͨ��C��C������̼����������̿�֪��E��F���ƣ������б���ȩ��CH3CH2MgBr�����������ͼ��֪��D��E���ڱ���������ȩ�������Ա���ȩ���ɱ���CHCl3��POCl3�Ͷ����������������Ƶã�����Ϣ��֪��CH3CH2MgBr����CH3CH2Br��Mg��������������Ƶã���CH3CH2Br����CH3CH2OH��HBr�����Ƶã��ʴ�Ϊ��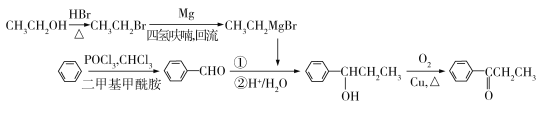 ��
��

 ������ÿ�ʱ��ҵϵ�д�
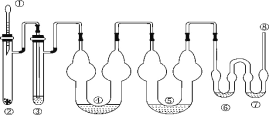
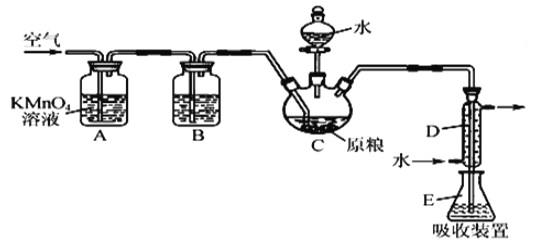
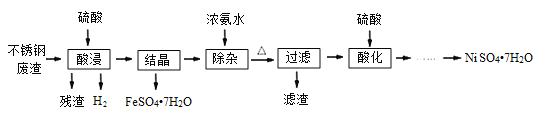
������ÿ�ʱ��ҵϵ�д�����Ŀ���������ǵ�ƹ�ҵ�ز����ٵĻ���ԭ�ϡ��Ӳ���ַ���(��Ҫ��Fe42.35%��Cr9.67%��Ni5.1%��C4.7%��Si3.39%��)����ȡ����������Ĺ���������ͼ��
 ��֪����Cr3+�백ˮ��Ӧʱ������Cr3+����[Cr(NH3)6]3+��������ʱ��������ֽ⡣Ni2+�백ˮ��Ӧ����[Ni(NH3)6]2+������������ʱ�ȶ����������ữʱ������Ӧ�������Ρ�
��֪����Cr3+�백ˮ��Ӧʱ������Cr3+����[Cr(NH3)6]3+��������ʱ��������ֽ⡣Ni2+�백ˮ��Ӧ����[Ni(NH3)6]2+������������ʱ�ȶ����������ữʱ������Ӧ�������Ρ�
��Na2CrO4��Һ�м������pHΪ3.5ʱ��CrO42-ת��ΪCr2O72-��
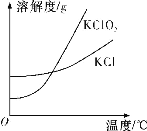
����������ڲ�ͬ�¶�ʱ�ܽ�����±���
�¶� �ܽ��/g ���� | 20�� | 30�� | 40�� | 60�� | 80�� | 90�� |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
��1�����������õ�����Һ����Ҫ����FeSO4��NiSO4��Cr2(SO4)3������NiSO4�Ļ�ѧ����ʽΪ___���������ʱ������¶�Ϊ90�����ң����Բ��õļ��ȷ�ʽ��___��
��2����������ǰ���ʵ����ȵ�Ŀ����___��
��3���������������õ���������ϴ�ӣ�����������ϴ�Ӹɾ��ķ�����___��
��4����������ʱ�����������������Ʊ�Na2Cr2O7���塣
���������������Na2CO3����ڿ�������������Na2CrO4��CO2���˷�Ӧ�Ļ�ѧ����ʽΪ___��
���벹�������������պ������Ʊ�Na2Cr2O7����(�Ⱥ�ɫ)��ʵ�鷽����ˮ�������ˣ�___����ɵ�Na2Cr2O7���壨����ʹ�õ��Լ��У����ᣬ����ˮ����