题目内容
【题目】标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。
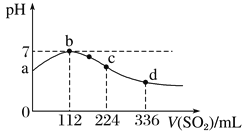
下列分析正确的是
A. 原H2S溶液的物质的量浓度为0.05 mol/L
B. 氢硫酸的酸性比亚硫酸的酸性强
C. b点水的电离程度比c点水的电离程度大
D. a点对应溶液的导电性比d点强
【答案】C
【解析】试题分析:A、根据图像可知当pH=7时二者恰好反应,根据方程式2H2S+SO2=2H2O+3S↓可知硫化氢的物质的量是![]() =0.01mol,所以原H2S溶液的物质的量浓度为0.01mol÷0.1L=0.1 mol/L,A错误;B、根据图像可知当溶液中SO2的物质的量与硫化氢的物质的量相等时,SO2溶液的pH小于硫化氢溶液的pH,所以氢硫酸的酸性比亚硫酸的酸性弱,B错误;C、b点显中性,c点是亚硫酸溶液,抑制水的电离,因此b点水的电离程度比c点水的电离程度大,C正确;D、a点氢离子浓度小于d点氢离子浓度,因此a点对应溶液的导电性比d点弱,D错误,答案选C。
=0.01mol,所以原H2S溶液的物质的量浓度为0.01mol÷0.1L=0.1 mol/L,A错误;B、根据图像可知当溶液中SO2的物质的量与硫化氢的物质的量相等时,SO2溶液的pH小于硫化氢溶液的pH,所以氢硫酸的酸性比亚硫酸的酸性弱,B错误;C、b点显中性,c点是亚硫酸溶液,抑制水的电离,因此b点水的电离程度比c点水的电离程度大,C正确;D、a点氢离子浓度小于d点氢离子浓度,因此a点对应溶液的导电性比d点弱,D错误,答案选C。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
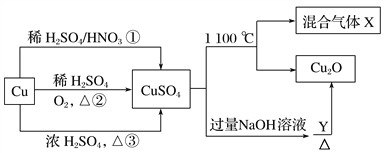
金牌教辅培优优选卷期末冲刺100分系列答案【题目】氯化钙常用于道路融冰剂和干燥剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al2O3、Fe2O3等杂质)制备氯化钙的主要流程如下:
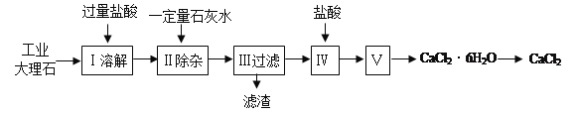 完成下列填空:
完成下列填空:
(1)上述使用的盐酸的物质的量浓度约为6.0mol/L,若用36.5%的盐酸(密度为1.2g/mL)配置6.0mol/L的盐酸100mL,所需的玻璃仪器有玻璃棒、量筒、胶头滴管、 ;需要量取36.5%的盐酸 mL;配制过程中,若其他操作都正确,下列操作会引起浓度偏小的是 。
A.定容摇匀后发现液面低于刻度线 |
B.定容时俯视容量瓶的刻度线 |
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作 |
D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线 |
(2)步骤Ⅰ中有关反应的离子方程式有: 、 、 。
(3)步骤Ⅱ控制石灰水用量的目的是防止(用离子方程式表示): 。
(4)滤渣的主要成分有(写化学式) 。
(5)步骤Ⅴ所含的操作依次是 、 。
(6)制得的氯化钙可以通过如下步骤测定其纯度:
①称取5.5g无水氯化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ 、 ;⑤称量。若得到4.3g碳酸钙,则氯化钙的质量分数为 ;若实验操作规范而测定结果偏低,其原因是 。