题目内容
【题目】氯化钙常用于道路融冰剂和干燥剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al2O3、Fe2O3等杂质)制备氯化钙的主要流程如下:
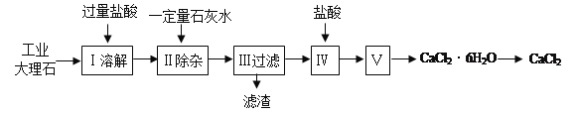 完成下列填空:
完成下列填空:
(1)上述使用的盐酸的物质的量浓度约为6.0mol/L,若用36.5%的盐酸(密度为1.2g/mL)配置6.0mol/L的盐酸100mL,所需的玻璃仪器有玻璃棒、量筒、胶头滴管、 ;需要量取36.5%的盐酸 mL;配制过程中,若其他操作都正确,下列操作会引起浓度偏小的是 。
A.定容摇匀后发现液面低于刻度线 |
B.定容时俯视容量瓶的刻度线 |
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作 |
D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线 |
(2)步骤Ⅰ中有关反应的离子方程式有: 、 、 。
(3)步骤Ⅱ控制石灰水用量的目的是防止(用离子方程式表示): 。
(4)滤渣的主要成分有(写化学式) 。
(5)步骤Ⅴ所含的操作依次是 、 。
(6)制得的氯化钙可以通过如下步骤测定其纯度:
①称取5.5g无水氯化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ 、 ;⑤称量。若得到4.3g碳酸钙,则氯化钙的质量分数为 ;若实验操作规范而测定结果偏低,其原因是 。
【答案】(1)烧杯、100ml容量瓶(各1分,多写1个扣1分,容量瓶没有写规格0分);50(2分);CD(2分、写对一个得1分,写错一个0分)
(2)CaCO3+2H+=Ca2++H2O+CO2↑(2分);Al2O3+6H+=2Al3++3H2O(2分);Fe2O3+6H+=2Fe3++3H2O(2分);
(3)Al(OH)3+OH-=AlO2-+2H2O(2分)
(4)Al(OH)3、Fe(OH)3(2分、写对一个得1分,写错一个0分)
(5)蒸发浓缩,冷却结晶(各1分)
(6)洗涤、干燥(各1分);87%(2分);洗涤时,有少量的碳酸钙溶解(2分)
【解析】试题分析:(1)要配制100ml6mol/L的盐酸,所需的玻璃仪器除了玻璃棒、量筒、胶头滴管外,还需要稀释用到的烧杯,转移时用到的100ml容量瓶。由于在稀释过程中溶质的质量不变,所以还需要量取36.5%的盐酸的体积为![]() =50ml。根据cB=
=50ml。根据cB=![]() 可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大,据此可以判断。A、定容摇匀后发现液面低于刻度线属于正确现象,浓度不变;B、定容时俯视容量瓶的刻度线,则容量瓶中溶液的体积减少,浓度偏高;C、将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作,则溶质的物质的量减少,测定结果偏低;D、如果加水超过了刻度线,取出少量水使液面恰好到刻度线,则导致溶质的物质的量减少,测定结果偏低,因此正确的答案选CD。
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大,据此可以判断。A、定容摇匀后发现液面低于刻度线属于正确现象,浓度不变;B、定容时俯视容量瓶的刻度线,则容量瓶中溶液的体积减少,浓度偏高;C、将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作,则溶质的物质的量减少,测定结果偏低;D、如果加水超过了刻度线,取出少量水使液面恰好到刻度线,则导致溶质的物质的量减少,测定结果偏低,因此正确的答案选CD。
(2)由于碳酸钙、氧化铁、氧化铝均能和盐酸反应,所以步骤Ⅰ中有关反应的离子方程式有CaCO3+2H+=Ca2++H2O+CO2↑、Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O。
(3)由于氢氧化铝是两性氢氧化物,能溶于强碱溶液中。所以步骤Ⅱ控制石灰水用量的目的是防止氢氧化钙过量溶解生成的氢氧化铝,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。
(4)由于溶液中的Al3+、Fe3+均和氢氧化钙反应生成Al(OH)3、Fe(OH)3沉淀,因此滤渣的主要成分是Al(OH)3、Fe(OH)3。
(5)步骤Ⅴ的主要目的是得到氯化钙晶体,所以所含的操作依次是蒸发浓缩,冷却结晶。
(6)沉淀过滤出来后需要洗涤并干燥。4.3g碳酸钙的物质的量=4.3g÷100g/mol=0.043mol,根据原子守恒可知氯化钙的物质的量也是0.043mol,则氯化钙的质量=0.043mol×111g/mol=4.773g,因此氯化钙的纯度=![]() ×100%=86.78%。碳酸钙不溶于水是相对的,不可能绝对不溶。由于在洗涤时,有少量的碳酸钙溶解,从而导致测定结果偏低。
×100%=86.78%。碳酸钙不溶于水是相对的,不可能绝对不溶。由于在洗涤时,有少量的碳酸钙溶解,从而导致测定结果偏低。