题目内容
【题目】氧化还原反应知识贯穿于中学化学教材,从初中阶段的简单了解,到高中基本理论知识,再到元素化合物部分的实际应用,再到化学电源本质的理解,再到有机化学中物质类型的变化关系,层层推进,高潮迭起。分析氧化还原反应常用双线桥法和单线桥法来表示电子转移的方向和数目。
I.在KClO3+6HCl=KCl+3Cl2↑+3H2O的反应中:
(1)请用单线桥法标出电子转移的方向和数目________;
(2)该反应中,氧化产物与还原产物的物质的量之比为_____________;
(3)若生成 0.3 mol Cl2,则转移的电子的数目为________________;
II.已知硫化亚铁是一种黑色块状固体,在空气中煅烧时生成二氧化硫气体和烧渣;硫化亚铁常温下难溶于水,易溶于稀盐酸、稀硫酸而生成能溶于水的硫化氢气体。硫化亚铁与浓硫酸加热条件下,可发生反应:2FeS+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑ +2S+6H2O:
Fe2(SO4)3+3SO2↑ +2S+6H2O:
(4)请用双线桥法标出电子转移的方向和数目_______。
(5)H2SO4在该反应中显示出来的性质是___________;(填序号)
A.氧化性 B.还原性 C.酸性 D.碱性
(6)该反应中,氧化产物是________________。
【答案】 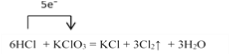 5∶1 0.5NA
5∶1 0.5NA 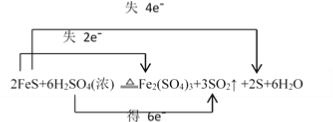 A C Fe2(SO4)3和S
A C Fe2(SO4)3和S
【解析】I.(1). 在6HCl + KClO3=KCl+3Cl2↑ +3H2O的反应中,KClO3中Cl元素从+5价降低到0价,HCl中Cl元素化合价从-1价升高到0价,根据得失电子守恒,用单线桥法表示的式子为: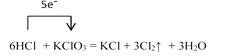 ,故答案为:
,故答案为: ;
;
(2).根据上述分析可知,在该反应中KClO3是氧化剂,HCl是还原剂,则氯气既是氧化产物也是还原产物,氧化产物和还原产物的物质的量之比为5:1,故答案为5:1;
(3).根据方程式可知,当有3mol氯气生成时,转移电子5mol,则生成 0.3 mol Cl2,转移电子的物质的量为0.5mol,数目为0.5NA,故答案为:0.5NA;
II.(4).在2FeS+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑ +2S+6H2O反应中,FeS中铁元素化合价从+2价升高到+3价,硫元素化合价从-2价升高到0价,H2SO4中硫元素化合价从+6价降低到+4价,根据得失电子守恒,则用双线桥法表示的式子为:
Fe2(SO4)3+3SO2↑ +2S+6H2O反应中,FeS中铁元素化合价从+2价升高到+3价,硫元素化合价从-2价升高到0价,H2SO4中硫元素化合价从+6价降低到+4价,根据得失电子守恒,则用双线桥法表示的式子为: ,故答案为:
,故答案为: ;
;
(5).在该反应中,部分硫酸生成硫酸铁和水,体现了硫酸的酸性,部分硫酸中的硫元素化合价降低,体现了硫酸的氧化性,故答案选AC;
(6).在该反应中,FeS中的铁元素和硫元素化合价都升高,则FeS是还原剂,产物Fe2(SO4)3和S都是氧化产物,故答案是:Fe2(SO4)3和S。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】I.CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体中CH4与CO2的分子个数比为_________;
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
II.根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④__________ | ⑤Na2SO4 ⑥K2CO3 | ⑦SO2 ⑧Na2O | ⑨HCl ⑩________ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的弱电解质,将化学式分别填在表中②、④、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为_______;
(3)将⑧的固体加入①的稀溶液中,反应的离子方程式为_______________;
(4)下列关于氧化物的叙述,正确的是_________。
A.金属氧化物一定属于碱性氧化物
B.碱性氧化物一定属于金属氧化物
C.非金属氧化物一定属于酸性氧化物
D.酸性氧化物一定属于非金属氧化物
(5)下列关于酸、碱、盐元素组成的说法中,正确的是_________。
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素
【题目】二氧化锆(ZrO2)是最重要的氧离子固体电解质,用于制造燃料电池、氧气含量测定仪等。可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2;含有少量Fe2O3、Al2O3、SiO2杂质)通过如下工艺流程法制得。
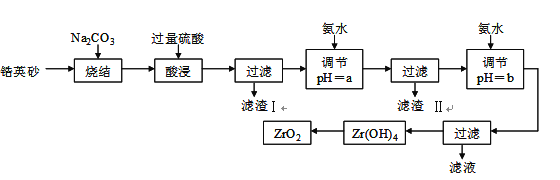
已知:①ZrO2具有两性,高温与纯碱共熔生成可溶于水的Na2ZrO3,与酸反应生成ZrO2+。②部分金属离子开始沉淀和完全沉淀的pH如下表:
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀的pH | 1.9 | 3.3 | 6.2 |
沉淀完全的pH | 3.2 | 5.2 | 8.0 |
请回答下列问题:
⑴烧结时ZrSiO4发生反应的化学方程式为_______________________;
滤渣I的化学式为______________________________。
⑵调节pH=a 的目的是________________________________________;用氨水调节pH=b后发生反应的离子方程式为______________________________________________。
⑶以滤渣II为主要原料制取铁红,请简述实验方法________________________。
⑷工业上用铝热法冶炼锆,写出以ZrO2通过铝热法制取锆的化学方程式:
________________________________________________________。
⑸一种新型燃料电池用掺杂Y2O3的ZrO2晶体作电解质在熔融状态下传导O2-,一极通入空气,另一极通入甲烷,写出负极的电极反应式为___________________________。