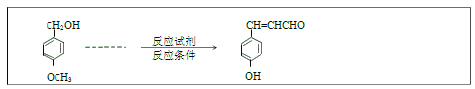
题目内容
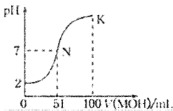
【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb)
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3H2O | 1.8×10-5 |
下表是常温下几种难(微)溶物的溶度积常数(Ksp):
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
CaSO4 | 7×10-5 |
CaCO3 | 5×10-9 |
请回答下列问题:
(l)写出HCN的电离方程式:___________,HClO的电子式__________。
(2)表中所给的四种酸中,酸性最强的是__________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大且电离常数改变的操作是__________(填字母序号)。
A.加少量冰酷酸 B.降低温度 C.加水稀释 D.升高温度 E.加少量的CH3COONa固体
(3)CH3COONH4的水溶液呈__________(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系是__________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BasO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.02 mol·L-1,则溶液中CO32-物质的量浓度应≥__________mol·L-1。
【答案】HCN![]() H++CN-
H++CN- ![]() HNO2 D 中性 c(
HNO2 D 中性 c(![]() )=c(CH3COO-)> c(H+)= c(OH-) 0.52
)=c(CH3COO-)> c(H+)= c(OH-) 0.52
【解析】
(1)由表可知,HCN为弱酸,其电离方程式为:HCN![]() H++CN-;HClO为共价化合物,其电子式为:
H++CN-;HClO为共价化合物,其电子式为:![]() ;
;
(2)电离平衡常数越大,酸的酸性越强,由表中数据可知,酸性最强的是:HNO2;要使电离平衡常数该变,则温度必须该变,弱电解质的电离为吸热过程,因此升高温度可增加电离程度,故答案为:D;
(3)CH3COOH的酸性与NH3H2O的碱性相同,因此CH3COONH4的水溶液呈中性;因微粒水解较为微弱,且CH3COO-与![]() 水解程度相同,故溶液中离子浓度大小关系为:c(
水解程度相同,故溶液中离子浓度大小关系为:c(![]() )=c(CH3COO-)> c(H+)= c(OH-);
)=c(CH3COO-)> c(H+)= c(OH-);
(4)该过程涉及反应:![]() ,该反应的平衡常数
,该反应的平衡常数 ,当溶液中
,当溶液中![]() 浓度不低于0.02mol/L,则
浓度不低于0.02mol/L,则![]() 。
。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案