题目内容
【题目】常温下,将0.1 mol BaSO4粉末置于盛有500 mL蒸馏水的烧杯中,然后烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )
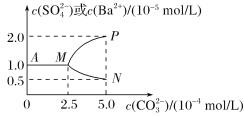
A. 相同温度时,Ksp(BaSO4)>Ksp(BaCO3)
B. BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大
C. 反应BaSO4(s)+CO32- (aq) ![]() BaCO3(s)+SO42- (aq),该反应的正反应平衡常数K1大于其逆反应的平衡常数K2
BaCO3(s)+SO42- (aq),该反应的正反应平衡常数K1大于其逆反应的平衡常数K2
D. 若使0.1 mol BaSO4全部转化为BaCO3,至少要加入2.6 mol Na2CO3
【答案】D
【解析】
A、根据图像,可以计算 Ksp(BaSO4)、Ksp(BaCO3);
B、BaSO4在BaCl2溶液中由于Ba2+的存在,使沉淀溶解平衡向生成沉淀方向移动,因此在BaCl2溶液中的溶解度变小,Ksp只随温度的改变而改变。
C. 反应BaSO4(s)+CO32- (aq) ![]() BaCO3(s)+SO42- (aq),正反应平衡常数K1=
BaCO3(s)+SO42- (aq),正反应平衡常数K1=![]() ,逆反应平衡常数K2=
,逆反应平衡常数K2=![]() ;
;
D使0.1molBaSO4转化为BaCO3,发生的反应为BaSO4(s)+CO32-(aq) ![]() BaCO3(s)+SO42- (aq),根据平衡常数计算至少要加入Na2CO3的物质的量。
BaCO3(s)+SO42- (aq),根据平衡常数计算至少要加入Na2CO3的物质的量。
A、根据图像,CO32-浓度为0时,c(Ba2+)、c(SO42-)都是1![]() ,所以 Ksp(BaSO4)= 1
,所以 Ksp(BaSO4)= 1![]() ,碳酸钡饱和溶液中当c(CO32-)= 5
,碳酸钡饱和溶液中当c(CO32-)= 5![]() 时,c(Ba2+)=0.5
时,c(Ba2+)=0.5![]() , Ksp(BaCO3)= 2.5
, Ksp(BaCO3)= 2.5![]() ,相同温度时,Ksp(BaSO4)<Ksp(BaCO3),故A错误;
,相同温度时,Ksp(BaSO4)<Ksp(BaCO3),故A错误;
B、BaSO4在BaCl2溶液中由于Ba2+的存在,使沉淀溶解平衡向生成沉淀方向移动,因此在BaCl2溶液中的溶解度变小,Ksp只随温度的改变而改变,无论在水中还是BaCl2溶液中,Ksp值是不变的,故B错误;
C. 反应BaSO4(s)+CO32- (aq) ![]() BaCO3(s)+SO42- (aq),正反应平衡常数K1=
BaCO3(s)+SO42- (aq),正反应平衡常数K1=![]() ,逆反应平衡常数K2=
,逆反应平衡常数K2=![]() ,根据A选项,Ksp(BaSO4)<Ksp(BaCO3),所以K1<1、K2>1,故C错误;
,根据A选项,Ksp(BaSO4)<Ksp(BaCO3),所以K1<1、K2>1,故C错误;
D、使0.1molBaSO4转化为BaCO3,发生的反应为BaSO4+CO32-![]() BaCO3+SO42-,根据图象,Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9,反应的平衡常数K1=
BaCO3+SO42-,根据图象,Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9,反应的平衡常数K1=![]() =0.04,若使0.1molBaSO4全部转化为BaCO3,则反应生成0.1molSO42-,
=0.04,若使0.1molBaSO4全部转化为BaCO3,则反应生成0.1molSO42-,![]() ═K=0.04,则平衡时n(CO32-)=2.5mol,则至少需要Na2CO3的物质的量为2.5mol+0.1mol=2.6mol,故D正确。
═K=0.04,则平衡时n(CO32-)=2.5mol,则至少需要Na2CO3的物质的量为2.5mol+0.1mol=2.6mol,故D正确。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】如图是元素周期表的一部分,按要求回答问题:
① |
| ||||||||||||||||
|
|
| ② | ③ | ④ |
|
| ||||||||||
⑤ | ⑥ |
|
|
|
|
|
|
|
|
|
| ⑦ |
|
| ⑧ | ⑨ |
|
(1)元素④在周期表中位置是_______。元素③的最高价氧化物的化学式为________。
(2)元素①⑤组成化合物电子式为___________。
(3)元素②的单质与⑧的最高价氧化物的水化物热的浓溶液反应的化学方程式为___。
(4)元素⑦与⑨形成的化合物与元素③的氢化物的水溶液反应的离子方程式为_____。
(5)元素④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为_____(用离子符号表示)。
(6)A—F发生如图所示的转化,A、B、C、D为①—⑨中某种元素形成的单质,E、F、G为B、C、D与A形成的二元化合物,G是一种常见温室气体,与B可以反应生成E,E中B元素的质量分数为60%,F为两性物质。

①A和F的化学式分别为_______、_______。
②B与G反应的化学方程式为____________________。
③C与NaOH溶液反应的离子方程式为______________。







