题目内容
已知:
| A.-393.5kJ/mol | B.-679.3 kJ/mol | C.-787 k J/mol | D.+180.9 kJ/mol |
A
解析试题分析:根据盖斯定律可知△H=△H1+△H2+△H3=(+175.3-283.0-285.8)kJ/mol="-393.5" kJ/mol
考点:考查盖斯定律的应用

练习册系列答案
相关题目
下列反应属于吸热反应的是 ( )
| A.中和反应 | B.锌与稀硫酸反应 |
| C.炭燃烧生成CO | D.炭与高温水蒸汽反应 |
下列关于能量转换的认识中不正确的是
| A.原电池工作时化学能全部转化为电能 |
| B.工业上电解氧化铝制备铝,电能转化成化学能 |
| C.镁在空气中燃烧时化学能不只转变成热能 |
| D.绿色植物光合作用过程中太阳能转变成化学能 |
下列关于化学反应与能量的说法正确的是( )
| A.化学反应中一定有物质变化但不一定有能量变化 |
B.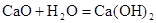 是放热反应,说明CaO的能量大于 是放热反应,说明CaO的能量大于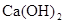 的能量 的能量 |
C.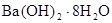 晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应 晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应 |
| D.由H2→2H的过程需要吸收能量 |
如图为反应2X(g)+Y(s)  2Z(g)的反应过程和能量关系图,下列说法正确的是( )
2Z(g)的反应过程和能量关系图,下列说法正确的是( )
| A.曲线a和b表示两个反应过程的反应热不同 |
| B.曲线a一定表示反应是在无催化剂时的反应过程 |
| C.增大压强,X的转化率一定增大 |
| D.反应达到平衡后,升高温度,平衡常数K值一定减小 |
下列反应属于吸热反应的是
| A.葡萄糖在人体内氧化分解 | B.氢气在氧气中燃烧 |
| C.氢氧化钡晶体与氯化铵晶体反应 | D.氢氧化钾和硫酸中和 |
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由C(石墨)=C(金刚石)△H="+1.90" kJ·mol-1可知,金刚石比石墨稳定 |
| C.在稀溶液中,H+(aq))+OH-(aq))=H2O(l)△H=-57.3 kJ·mol-1,若将含0.5 molH2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |
| D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2 H2(g)+O2(g)="2" H2O(1)△H=-285.8 kJ·mol-1 |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ/mol |
| B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.Ba(OH)2·8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行 |
下列说法正确的是
A.右图可表示水分解过程中的能量变化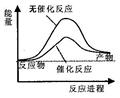 |
| B.若2C(s)+O2(g)=2CO(g)△H=" -221.0" kJ/mol,则碳的燃烧热为110.5 kJ/mol |
| C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)="2HCl" (g)△H=" -" a kJ/mol, |

且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为- a-b-c kJ