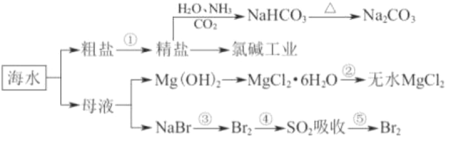
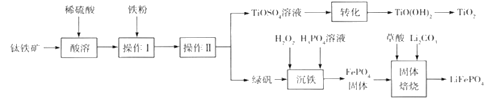
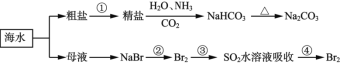
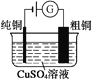
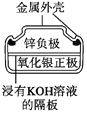
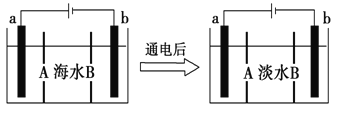
题目内容
【题目】2019年是门捷列夫提出元素周期表150周年。已知在元素周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。W与Q可以形成一种高温结构陶瓷材料,W的氯化物分子呈正四面体结构。回答下列问题:
(1)元素X在元素周期表中的位置_________
(2)W的氧化物的晶体类型是____________
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是________
(4)这5个元素的氢化物分子中:
①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)_______
②电子总数相同的氢化物的化学式和立体结构分别是_________
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是_________。
【答案】第三周期第ⅤA族 原子晶体 As2S5 NH3> AsH3 >PH3 电子数相同的有SiH4(正四面体)、PH3(三角锥型)和H2S(V形) SiCl4 + 4NH3 = Si(NH2)4 + 4HCl, 3Si(NH2)4 = 8NH3 + Si3N4
【解析】
W的氯化物分子呈正四面体结构,应为SiCl4或CCl4,又W与Q可以形成一种高温结构陶瓷材料,可推断W为Si,Q为N元素;元素Q、R、W、Y与元素X相邻,Y的最高化合价氧化物的水化物是强酸,则Y为S,X为P,R为As元素。
根据分析可知,Q为N,R为As,W为Si,Y为S,X为P元素。
(1)P的原子序数为15,位于元素周期表中第三周期第ⅤA族;
(2)W的氧化物为二氧化硅,二氧化硅属于原子晶体;
(3)As的最高价为+5价,则As和S形成的二元化合物的化学式为As2S5;
(4)①氨气分子间存在氢键,其沸点最高;AsH3、PH3都属于分子晶体,相对分子质量越大沸点越高,则沸点大小为:NH3>AsH3>PH3;
②这5个元素的氢化物分子中,SiH4、PH3和H2S的电子数均为18,价电子对数分别为![]() ,
,![]()
![]() ,孤对电子对分别为0,1,2,因此其空间结构分别为正四面体,三角锥和V形;
,孤对电子对分别为0,1,2,因此其空间结构分别为正四面体,三角锥和V形;
(5)由信息可知,四氯化硅与氨气反应生成W(QH2)4和HCl,Si(NH2)4在高温下分解生成氨气和氮化硅,反应方程式分别为:SiCl4+4NH3=Si(NH2)4+4HCl、3 Si(NH2)4=8NH3+Si3N4。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】如表是元素周期表主族元素的一部分,短周期元素X的最高正价是+5价,Y单质可在空气中燃烧。
W | X | Y |
Z |
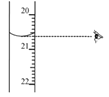
(1)Z的元素符号是________,原子结构示意图是_________。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,反应的化学方程式为_________。
(3)探寻同一族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式。
编号 | 性质推测 | 化学方程式 |
示例 | 氧化性 | H2ZO3+4HI=Z↓+2I2+3H2O |
1 | ____ | ____ |
2 | ____ | ____ |