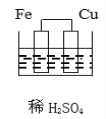
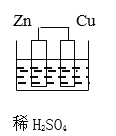
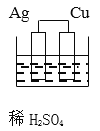
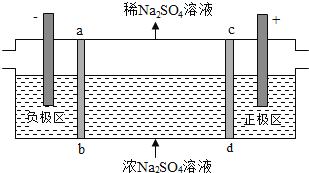
题目内容
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:![]() 已知
已知![]()
容器 | 甲 | 乙 | 丙 |
反应物的投入量 |
|
|
|
|
|
|
|
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系的压强 |
|
|
|
反应物的转化率 |
|
|
|
下列说法正确的是![]()
![]()
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
【答案】B
【解析】甲容器内的平衡与乙容器内平衡是等效平衡, 所以平衡时NH3的浓度相等,即c1=c2,丙容器反应物投入量4molNH3,是乙的二倍,相当于增大压强,平衡正移,所以丙中氨气的浓度大于乙中氨气浓度的二倍,即c3>2c2,即c3>2c1,2P2>P3,![]() ,所以
,所以![]() .
.
A.甲容器内的平衡与乙容器内平衡是等效平衡, 所以平衡时NH3的浓度相等,即c1=c2,丙容器反应物投入量4molNH3,是乙的二倍,相当于增大压强,平衡正移,所以丙中氨气的浓度大于乙中氨气浓度的二倍,即c3>2c2,即c3>2c1,A错误;
B.乙中开始投入2molNH3,则甲与乙是等效的,甲与乙的反应的能量变化之和为92.4kJ,故a+b=92.4,B正确;
C.丙容器反应物投入量4molNH3,是乙的二倍,反应起始时2P2=P3,由于合成氨的反应是气体体积减小的反应,故2P2>P3,C错误;
D.丙容器反应物投入量4molNH3,是乙的二倍,相当于增大压强,平衡向右移动,所以丙中氨的转化率比乙小,因为![]() ,所以
,所以![]() ,D错误。
,D错误。
本题选B .

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案【题目】现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
回答下列问题:
(1) ③的元素符号是_________,⑧的元素名称是_________。①在元素周期表中的位置是 (周期、族)_________________________________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是___________;碱性最强的化合物的电子式是:________________;属________化合物(填“离子”或“共价”
(3)比较④和⑦的氢化物的稳定性(用化学式表示)________________________。
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:________________。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:_______________。