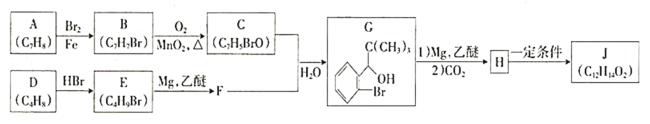
题目内容
【题目】锌在电池制造方面有着重要的作用,也是人体必需的微量元素之一。它与常见的非金属都可以形成重要的化合物。
(1)Zn的核外电子排布式是[Ar]___。
(2)Zn的各级电离能数据如下表所示:

①请依据表中数据说明锌的常见化合价为+2的原因是___。
②氧、硫、氯三种常见非金属的电负性,由大到小的顺序是___。二氯化硫为鲜红色液体,熔点-78℃,则其晶体中微粒间的作用力应属于___,它的分子中中心原子具有的孤电子对数是___。
(3)氯化锌易溶于水,在水中形成配合物H[ZnCl2(OH)],H[ZnCl2(OH)]在水中电离时的离子方程式为___。
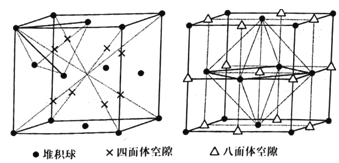
(4)晶胞的空隙问题是晶胞研究的重要内容。
①已知面心立方晶胞的四面体空隙和八面体空隙状况如图所示。面心立方晶胞的每个晶胞中,堆积球数:四面体空隙数:八面体空隙数=___。
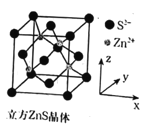
②根据立方ZnS晶胞示意图,描述在每个晶胞中,锌离子填充在硫离子的立方面心晶胞空隙中的方式为___。离坐标参数为(0,0,0)的硫离子最近的锌离子坐标参数为___ (参数数值限定为正值)。
【答案】3d104s2 因为第2和第3级电离能的差值远高于第2和第1级的差值 O>Cl>S 范德华力 2 H[ZnCl2(OH)]=[ZnCl2(OH)]-+H+ 1:2:1 锌离子填充到硫离子面心晶胞的一半四面体空隙中(或锌离子填充到硫离子面心晶胞的8个四面体空隙的4个中) (![]() ,
,![]() ,
,![]() )
)
【解析】
Zn是30号元素,价电子为3d104s2,失去第三个电子非常困难,第三电离能较大;电负性的大小比较根据元素周期律的知识;由熔沸点确定晶体类型,得到晶体中微粒间的作用力;孤电子对数的计算用最外层电子数减去成键电子数,再除以2;四面体空隙:由四个球体围成的空隙,球体中心线围成四面体;八面体空隙:由六个球围成的空隙,球体中心线围成八面体形;坐标参数的确定先找出位置,再确定到到x、y、z轴的距离,得到坐标参数。
(1) Zn是30号元素,核外电子排布式是[Ar] 3d104s2;
(2)①Zn的价电子为3d104s2,失去最外的两个电子就形成稳定结构,再失去电子就比较困难,电离能会增加很多,原因是因为第2和第3级电离能的差值远高于第2和第1级的差值;
②同一周期中,元素的电负性随着原子序数的增大而增大,有Cl>S,同一主族,元素的电负性随着原子序数的增大而减小,有O>S,氧原子的半径小于氯,吸引电子能力强,有O>Cl,所以电负性O>Cl>S;二氯化硫为液体,熔点-78℃,熔沸点都较低,为分子晶体,则其晶体中微粒间的作用力应属于范德华力;二氯化硫分子中,氯原子最外层7个电子,形成一对公用电子对,硫原子最外层6个电子,中心原子硫原子具有的孤电子对数是![]() ;
;
(3) 配合物中外界电离成离子,內界不电离,所以H[ZnCl2(OH)]在水中电离时的离子方程式为[ZnCl2(OH)]=[ZnCl2(OH)]-+H+;
(4) ①堆积球数采用均摊法,![]() ;根据图四面体空隙位于八分之一晶胞的立方体心位置,一共有8个;八面体空隙位于晶胞体心(1个)和棱心(
;根据图四面体空隙位于八分之一晶胞的立方体心位置,一共有8个;八面体空隙位于晶胞体心(1个)和棱心(![]() 个),一共有4个;所以堆积球数:四面体空隙数:八面体空隙数=1:2:1;
个),一共有4个;所以堆积球数:四面体空隙数:八面体空隙数=1:2:1;
②根据立方ZnS晶胞示意图,每个硫离子的面心晶胞有8个四面体空隙,锌离子只填充了4个,所以答案为:锌离子填充到硫离子面心晶胞的一半四面体空隙中(或锌离子填充到硫离子面心晶胞的8个四面体空隙的4个中);如下图,将a球设为坐标原点,离硫离子最近的锌离子为b球,b球在周围4个硫离子(a球和a球对应的三个面的面心)的中心,则b球到x、y、z轴的距离都是![]() ,坐标参数为(
,坐标参数为(![]() ,
,![]() ,
,![]() )。
)。


【题目】氮可形成多种氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是![]() 和
和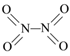 。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能167kJ·mol-1,NO2中氮氧键的平均键能466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
(1)写出N2O4转化为NO2的热化学方程式_________________________
(2)对反应N2O4(g)![]() 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是______
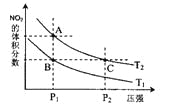
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.400mol的NO2气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_____mol·(L·s)-1。
②n3____n4(填“>”、“<”或“=”),该反应的平衡常数K的值为_____________,升高温度后,反应2NO2![]() N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将_______(填“增大”、“减小”或“不变”)。
③若在相同情况下最初向该容器充入的是N2
④计算③中条件下达到平衡后混合气体的平均相对分子质量为____________。(结果保留小数点后一位)