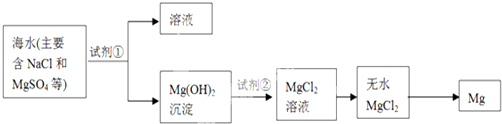
题目内容
18.配平氧化还原反应方程式,标出电子转移的方向和数目.(1)8NH3+6NO2-_7N2+12H2O
(2)该反应中氧化产物与还原产物的质量比为4:3.
(3)可逆反应:aA(g)+bB(g)cC(g)+dD(g)△H=正值kJ•mol-1(正值或负值)
根据如图回答:
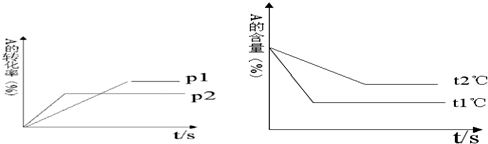
①压强 P1比P2小填(“大”或“小”)
②(a+b)比(c+d)小填(“大”或“小”)
③温度t1℃比t2℃高填(“高”或“低”)
④△H值为正填(“正”或“负”)(正值表示正反应吸热,负值表示正反应放热)
分析 (1)依据元素化合价的变化分析,氮元素化合价-3价和+3价变化为0价,结合电子守恒和原子守恒配平书写化学方程式;
(2)依据氧化剂和还原剂概念结合化学方程式中的定量关系计算;
(3)依据图象变化特征分析,先拐先平,温度高,压强大,t1>t2,温度越高A%越小,说明升温平衡正向进行,正反应为吸热反应,P1<P2,压强越大A的转化率越小,说明增大压强平衡逆向进行,逆向为气体体积减小的反应.
解答 解:(1)氮元素化合价-3价和+3价变化为0价,电子转移为3,结合电子守恒和原子守恒配平书写化学方程式8NH3+6NO2-=7N2+12H2O,
故答案为:8、6、7、12;
(2)8NH3+6NO2-=7N2+12H2O反应中,氧化剂为NO2-,氧化产物为N2,还原剂为NH3被氧化为N2,氧化产物与还原产物的质量比为8:6=4:3,
故答案为:4:3;
(3)图象变化特征分析,先拐先平温度高,t1>t2,温度越高A的含量越小,说明升温平衡正向进行,正反应为吸热反应,△H>0,先拐先平压强大P1<P2,压强越大A的转化率越小,说明增大压强平衡逆向进行,逆向为气体体积减小的反应,a+b<c+d,
故答案为:正值、小、小、高、正.
点评 本题考查了化学平衡影响因素的分析判断,图象分析方法,氧化还原反应产物的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
6.环境保护意识越来越深入人心,许多城市对垃圾实行分类回收处理,禁止使用对环境污染的物品.废旧电池集中处理的首要原因是( )
| A. | 回收电池中的石墨电极 | |
| B. | 回收电池外壳金属材料 | |
| C. | 防止电池中汞、镉、铜等重金属对土壤和水源的污染 | |
| D. | 防止电池中的渗出液腐蚀其它物品 |
13.下列各组离子在无色溶液中能大量共存,且加入铝粉一定能放出氢气的是( )
| A. | Fe2+、Na+、H+、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ba2+、Na+、OH-、NO3- | D. | Na+、Mg2+、NO3-、OH- |
3.下列各冶炼方法中,不能制得相应金属的是( )
| A. | 加热氧化铝 | B. | 电解熔融氯化钠 | ||
| C. | 把铁放入硫酸铜溶液中 | D. | 铝粉与氧化铁高温共热 |
10.对如图所示装置,叙述正确的是( )
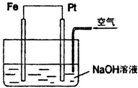

| A. | Fe是正极,Pt是负极 | B. | 该装置中,电子从Fe流向Pt | ||
| C. | 正极反应为:2H++2e-═H2↑ | D. | 负极反应为:4OH--4e-═2H2O+O2↑ |
7.25℃时,在100g质量分数为10%的X溶液中加入5g X(无水盐)后,恰好达到饱和,则25℃时X的溶解度为( )
| A. | 10.0g | B. | 15.0g | C. | 16.7g | D. | 18.8g |
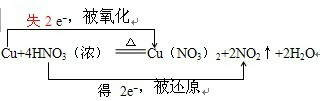 .
.