题目内容
【题目】如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于( )

A.锌和盐酸生成氢气
B.氯酸钾和二氧化锰生成氧气
C.碳酸钙和盐酸生成二氧化碳
D.氯化钠和浓硫酸生成氯化氢
【答案】A
【解析】
A.生成氢气混有HCl,HCl极易溶于水,浓硫酸干燥氢气,最后向下排空气法收集氢气,故A选;
B.氯酸钾分解制氧气需要使用固固加热装置,且氧气的密度比空气密度大,应选向上排空气法收集,故B不选;
C.二氧化碳的密度比空气密度大,应选向上排空气法收集,故C不选;
D.氯化钠和浓硫酸反应制备HCl需要固液加热装置;生成的HCl极易溶于水,不能选水除去杂质;且最后收集方法不合理,应选向上排空气法收集,故D不选;
故答案选A。

 习题精选系列答案
习题精选系列答案【题目】KIO3 是一种重要的无机化合物,可作为食盐中的补碘剂。利用“KClO3 氧化法”制备 KIO3 工艺流程如下图所示,回答下列问题:
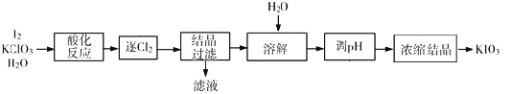
(1)“酸化反应”所得产物有 KH(IO3)2、Cl2 和 KCl。“逐 Cl2”采用的方法是________;
(2)“滤液”中的溶质主要是_______;“调 pH”中发生反应的化学方程式为_____________________;
(3)结晶过滤时工人发现 KH(IO3)2 为悬浮絮状沉淀,以下可以采用的方法是________;
A.倾析法 B.重结晶法 C.抽滤法 D. 离心分离法
(4)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂 X 调整反应后溶液的 pH,对生产碘酸钾有什么具体影响_________________________________________________________________;
(5)KIO3 也可采用“电解法”制备,装置如图所示。与“电解法”相比,“KClO3 氧化法”的主要不足之处有_____________________________________;(写出一点)

(6)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取 w g 食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量 KI 溶液,使 KIO3 与 KI 反应完全;
c.以淀粉为指示剂,加入物质的量浓度为2.0×10-3mol·L-1 的 Na2S2O3 溶液 10.0mL 恰好反应。 则加碘食盐样品中的碘元素含量是______________mg/kg;(以含 w 的代数式表示)
(7)学生乙又对纯净的 NaCl(不含 KIO3)进行了下列实验:
操作步骤 | 实验现象 |
取 1g 纯净的 NaCl,加 3mL 水配成溶液。 | 溶液无变化 |
滴入 5 滴淀粉溶液和 1mL 0.1 mol·L-1KI 溶液,振荡。 | 溶液无变化 |
然后再滴入 1 滴 1mol·L-1 的 H2SO4,振荡。 | 溶液变蓝色 |
根据学生乙的实验结果,请对学生甲的实验结果作出简要评价___________________________。
【题目】乙二酸俗名草酸,易溶于水,为了测定草酸晶体H2C2O4·xH2O中的x值,某实验小组进行实验,步骤如下:
①称取1.260g草酸晶体,配成100mL溶液。
②取25.00mL该H2C2O4溶液加入锥形瓶内,再加入适量稀硫酸。
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,至滴定达到终点。
④重复实验。记录整理数据如下:
实验序号 | V(KMnO4溶液) | |
滴定前刻度/mL | 滴定后刻度/mL | |
1 | 0.10 | 10.00 |
2 | 1.10 | 11.10 |
3 | 1.50 | 13.50 |
4 | 0.70 | 10.80 |
回答下列问题:
(1)乙二酸和KMnO4标准溶液反应的离子方程式为____________
(2)步骤①需要使用烧杯、量筒、玻璃棒、胶头滴管,还缺少的玻璃仪器为_______(填名称);步骤③滴定过程中,盛装KMnO4溶液的仪器为__________________(填名称)。
(3)本实验滴定达到终点的标志是__________________________;
(4)根据数据,计算H2C2O4溶液的物质的量浓度为______mol/L,x=____________;
(5)若滴定终点时仰视滴定管刻度,则x值会_____________(填“偏大”、“偏小”或“不变”) 。




