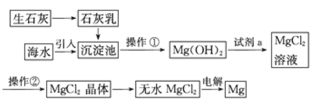
题目内容
【题目】汽车尾气中NOx的生成和消除是科学家研究的重要课题。
(1)NOx能形成酸雨,NO2转化为HNO3的化学方程式是__。
(2)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g) H=+180kJ·mol-1,其能量变化示意图如下:
![]()
则NO中氮氧键的键能是__kJ·mol-1。
(3)用NH3可消除NO污染,反应原理为:4NH3+6NO![]() 5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
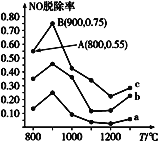
①曲线a对应的n(NH3):n(NO)=__。
②曲线c中NO的起始浓度为4×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为__mg/(m3·s)。
③由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降,可能的原因是__(至少写两条)。
【答案】3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3 632 1:3 1×10-4 ⅰ、催化剂的活性下降;ⅱ、氨气可能发生分解;ⅲ、反应为放热反应,温度高反应速率快,达到平衡后平衡逆向移动
【解析】
(1)NO2和水反应生成HNO3和NO。
(2)根据H=反应物化学键断裂吸收的能量-生成物的化学键形成释放的能量,计算氮氧键的键能;
(3)NH3和NO的物质的量的比值越大,NO的脱除率越大,则n(NH3):n(NO)为4:1、3:1、1:3时,对应的曲线为c、b、a。由题给信息,可类比反应速率的定义进行NO的脱出速率的计算。温度升高,NO的脱除率降低,可根据可逆反应的平衡移动进行分析。
(1)NO2与水发生反应:3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3;答案为:3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3;
(2)根据H=反应物化学键断裂吸收的能量-生成物的化学键形成释放的能量,可得:946kJ·mol-1+498 kJ·mol-1-2a kJ·mol-1=180kJ,解得:a=632。答案为:632;
(3)①由分析可知,曲线a对应的n(NH3):n(NO)=1:3;答案为:1:3;
②由图可知,A点到B点,NO的脱除率为0.75-0.55=0.20,则从A点到B点![]() ,则从A点到B点内NO的脱除率为
,则从A点到B点内NO的脱除率为![]() ,答案为:1×10-4;
,答案为:1×10-4;
③可从催化剂、可逆反应的平衡移动、反应物或生成物随温度变化的角度进行分析。在温度超过900℃时NO脱除率都会骤然下降,可能的原因有:ⅰ、催化剂的活性下降;ⅱ、氨气可能发生分解;ⅲ、反应为放热反应,升高温度,达到平衡后平衡逆向移动;答案为:ⅰ、催化剂的活性下降;ⅱ、氨气可能发生分解;ⅲ、反应为放热反应,升高温度,达到平衡后平衡逆向移动。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案