题目内容
【题目】用MnO2为原料可制取电极材料锰酸锂(LiMnxOy),工业上利用菱锰矿粉(MnCO3)制备MnO2的流程如图:
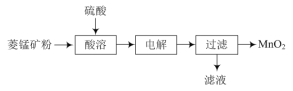
(1)“酸溶”过程中加入过量的硫酸目的是___。
(2)写出“电解”反应的离子反应方程式:___。
(3)为测定LiMnxOy中Mn元素的平均化合价(高于+2价),现进行如下实验:
步骤1:取少量LiMnxOy,分成两等份,分别置于两只锥形瓶中;
步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.400mol·L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);
步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol·L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液16.00mL。
步骤3实验过程中物质发生的转化如下,其中C2O42-均转化为CO2:
LiMnxOy![]() Mn2+;MnO
Mn2+;MnO![]()
![]() Mn2+
Mn2+
①步骤3滴定终点时的实验现象是___。
②计算LiMnxOy中Mn元素的平均化合价___(写出计算过程)。
【答案】提高锰元素的浸出率,抑制Mn2+水解 Mn2++2H2O![]() MnO2↓+2H++H2↑ 当加入最后一滴高锰酸钾溶液,溶液变为浅红色,且半分钟内不褪色 3.5
MnO2↓+2H++H2↑ 当加入最后一滴高锰酸钾溶液,溶液变为浅红色,且半分钟内不褪色 3.5
【解析】
工业上利用菱锰矿粉(MnCO3)制备MnO2,加入过量硫酸进行酸溶,使矿粉完全反应,提高浸出率,同时酸性环境抑制Mn2+的水解,得到硫酸锰溶液,经过电解,过滤得到MnO2,说明电解过程Mn2+转化为MnO2。
(1)“酸溶”过程中加入过量的硫酸可以提高Mn2+浸出率,同时抑制Mn2+水解;
(2)由分析可知“电解”过程Mn2+转化为MnO2,发生氧化反应,酸性环境,“电解”反应的离子反应方程式:Mn2++2H2O ![]() MnO2↓+2H++H2↑
MnO2↓+2H++H2↑
(3)①步骤3用KMnO4标准溶液滴定,故滴定终点时的实验现象是:当加入最后一滴高锰酸钾溶液,溶液由无色变为浅红色,且半分钟内不褪色;
②取少量LiMnxOy,分成两等份,由步骤二LiMnxOy中Mn元素转化为Mn2+,Mn2+与EDTA反应的化学计量数之比为1∶1,n(Mn2+)=n(EDTA)= 0.400mol·L-1×0.02L=0.008mol,则LiMnxOy中含Mn元素0.008mol;步骤3:通过返滴定,根据氧化还原价态规律可得计量关系: 2MnO![]() ~5Na2C2O4 ,n(MnO
~5Na2C2O4 ,n(MnO![]() )= 0.100mol·L-1×0.016L=0.0016mol,消耗n(Na2C2O4)=0.004mol;2LiMnxOy ~(2y-2x-1)Na2C2O4 ~ 2xMn2+,总共加入Na2C2O4质量1.340g,物质的量0.01mol,由高锰酸钾消耗草酸钠0.004mol,则由LiMnxOy消耗草酸钠n(Na2C2O4)=0.006mol,同时n(Mn2+) =0.008mol,可列出
)= 0.100mol·L-1×0.016L=0.0016mol,消耗n(Na2C2O4)=0.004mol;2LiMnxOy ~(2y-2x-1)Na2C2O4 ~ 2xMn2+,总共加入Na2C2O4质量1.340g,物质的量0.01mol,由高锰酸钾消耗草酸钠0.004mol,则由LiMnxOy消耗草酸钠n(Na2C2O4)=0.006mol,同时n(Mn2+) =0.008mol,可列出![]() ,化简得4y-7x-2=0,由于氧元素的化合价为-2,则可以把等式写成2y=3.5x+1,故Mn平均化合价为+3.5。
,化简得4y-7x-2=0,由于氧元素的化合价为-2,则可以把等式写成2y=3.5x+1,故Mn平均化合价为+3.5。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是
选项 | 分子式 | 中心原子杂化方式 | 价层电子对互斥模型 | 分子或离子的立体构型 |
A | SO2 | sp | 直线形 | 直线形 |
B | HCHO | sp2 | 平面三角形 | 三角锥形 |
C | H3O+ | sp2 | 四面体形 | 平面三角形 |
D | NH4+ | sp3 | 正四面体形 | 正四面体形 |
A. AB. BC. CD. D