题目内容
3.下列各组离子在溶液中可以大量共存的是( )| A. | Ag+,K+,NO3-,Cl- | B. | Cu2+,Cl-,NO3-,OH- | ||
| C. | Ca2+,Cl-,CO32-,NO3- | D. | Mg2+,Cl-,SO42-,Na+ |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.Ag+、Cl-结合生成沉淀,不能大量共存,故A错误;
B.Cu2+、OH-结合生成沉淀,不能大量共存,故B错误;
C.Ca2+、CO32-结合生成沉淀,不能大量共存,故C错误;
D.该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,注意常见的难溶物,题目难度不大.

练习册系列答案
相关题目
18.下列物质中的划横线元素的原子,其全部最外层电子都参与形成共价键的是( )
| A. | NH3 | B. | H2O | C. | HCl | D. | CH4 |
14.决定一定物质的量气体体积大小的主要因素是( )
| A. | 气体分子的大小 | B. | 气体分子的质量 | ||
| C. | 气体分子间距离的大小 | D. | 气体分子的组成 |
11.Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)?Z(g).则下列说法一定正确的是( )
| A. | 若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ=Ⅱ | |
| B. | 若X、Y均为气态,则平衡时气体X的转化率:Ⅰ>Ⅱ | |
| C. | 若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间不相同 | |
| D. | 平衡时Ⅰ容器的体积小于VL |
18.下列说法正确的是( )
| A. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| B. | 用溴水鉴别苯和正己烷 | |
| C. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| D. | 乙烯和苯都能使溴水褪色,褪色的原因不相同 |
15. 喷泉是一种常见的自然现象,其产生的原因是存在压强差,如图所示装置是常见的喷泉实验装置.在圆底烧瓶中分别收集干燥纯净的气体,烧杯和胶头滴管中分别盛放同一种液体.当挤入胶头滴管中液体时,下列实验不能出现喷泉现象的是( )
喷泉是一种常见的自然现象,其产生的原因是存在压强差,如图所示装置是常见的喷泉实验装置.在圆底烧瓶中分别收集干燥纯净的气体,烧杯和胶头滴管中分别盛放同一种液体.当挤入胶头滴管中液体时,下列实验不能出现喷泉现象的是( )
 喷泉是一种常见的自然现象,其产生的原因是存在压强差,如图所示装置是常见的喷泉实验装置.在圆底烧瓶中分别收集干燥纯净的气体,烧杯和胶头滴管中分别盛放同一种液体.当挤入胶头滴管中液体时,下列实验不能出现喷泉现象的是( )
喷泉是一种常见的自然现象,其产生的原因是存在压强差,如图所示装置是常见的喷泉实验装置.在圆底烧瓶中分别收集干燥纯净的气体,烧杯和胶头滴管中分别盛放同一种液体.当挤入胶头滴管中液体时,下列实验不能出现喷泉现象的是( )| 气 体 | 液 体 | 气 体 | 液 体 | ||
| A | HCl | 蒸馏水 | B | SO2 | 浓烧碱液 |
| C | NO | 浓烧碱液 | D | NH3 | 蒸馏水 |
| A. | A | B. | B | C. | C | D. | D |
12.有关核电荷数为1~18的元素,下列叙述中正确的是( )
| A. | 最外层只有1个电子的元素一定是金属元素 | |
| B. | 最外层只有2个电子的元素一定是金属元素 | |
| C. | 原子核外各层电子数相等的元素不一定是金属元素 | |
| D. | 核电荷数为17的元素的原子易获得1个电子 |
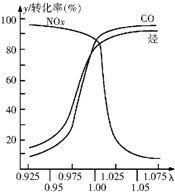 随着经济的发展和生活水平的提高,近年来我省汽车拥有量呈较快增长趋势.
随着经济的发展和生活水平的提高,近年来我省汽车拥有量呈较快增长趋势.