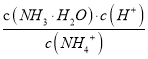题目内容
【题目】研究化学反应的热效应有利于更好的利用化学能。下列说法正确的是( )
A.放热反应任何条件下一定能自发进行
B.升高温度可以增加分子的活化能
C.生成物总能量高于反应物总能量的反应为放热反应
D.生成物的键能总和大于反应物的键能总和的反应为放热反应
【答案】D
【解析】
A.有些放热反应需要在加热条件下才能进行,如铝热反应,故A错误;
B.升高温度,可使更多分子转化为活化分子,不能说增加分子的活化能,故B错误;
C.生成物总能量高于反应物总能量的反应,反应过程中吸收能量,为吸热反应,故C错误;
D.生成物的键能总和大于反应物的键能总和,说明释放能量大于吸收能量,该反应为放热反应,故D正确;
故答案为D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知1 g氢气完全燃烧生成液态水时放出热量143kJ, 18g水蒸气变成液态水放出44kJ的热量。其他相关数据如下表:
O=O | H-H | H-O(g) | |
1mol化学键断裂需要吸收的能量/kJ | 496 | 436 | x |
则表中x为
A. 188 B. 463 C. 557 D. 920
【题目】能源、环境与生产生活和社会发展密切相关。
一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH = -49.0 kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) ΔH = -49.0 kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2(g)和3 mol H2(g) | 32g CH3OH(g)和18g H2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4 kJ | 吸收a kJ |
(1)c1____(填“>”、“<”或“=”)c2,a=____。
(2)该反应的平衡常数表达式为K=____;若甲中反应10 s 时达到平衡,则0~10 s内甲中的平均反应速率v(H2)=______。
(3)下列情况能说明该反应一定达到平衡状态的是____(填字母)。
a. v(CO2)消耗=v(CH3OH)生成 b. 气体的密度不再随时间改变
c. CO2和CH3OH的浓度之比不再随时间改变 d. 气体的平均相对分子质量不再随时间改变