题目内容
【题目】能源、环境与生产生活和社会发展密切相关。
一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH = -49.0 kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) ΔH = -49.0 kJ·mol-1。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2(g)和3 mol H2(g) | 32g CH3OH(g)和18g H2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4 kJ | 吸收a kJ |
(1)c1____(填“>”、“<”或“=”)c2,a=____。
(2)该反应的平衡常数表达式为K=____;若甲中反应10 s 时达到平衡,则0~10 s内甲中的平均反应速率v(H2)=______。
(3)下列情况能说明该反应一定达到平衡状态的是____(填字母)。
a. v(CO2)消耗=v(CH3OH)生成 b. 气体的密度不再随时间改变
c. CO2和CH3OH的浓度之比不再随时间改变 d. 气体的平均相对分子质量不再随时间改变
【答案】 = 19.6 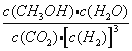 0.09 mol·L-1·s-1 cd
0.09 mol·L-1·s-1 cd
【解析】本题主要考查化学平衡的移动。
(1)容器甲、乙建立相同平衡状态,故c1=c2,a=49.0-29.4=19.6。
(2)该反应的平衡常数表达式为K=![]() ;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=3mol×29.4/49.0/2.0L/10s=0.09 mol·L-1·s-1。
;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=3mol×29.4/49.0/2.0L/10s=0.09 mol·L-1·s-1。
(3)a. v(CO2)消耗、v(CH3OH)生成都是正反应速率,故a不能说明该反应一定达到平衡状态;b. 气体的质量、体积不变,所以气体的密度一直保持不变,故b不能说明该反应一定达到平衡状态;c. CO2和CH3OH的浓度之比随着反应进行而改变,当CO2和CH3OH的浓度之比不再随时间改变时,说明反应达到平衡状态,故c能说明该反应一定达到平衡状态;d. 该反应气体物质的量有变化,气体质量守恒,气体的平均相对分子质量随着反应进行而改变,当气体的平均相对分子质量不再随时间改变时,说明反应达到平衡状态,故d能说明反应该反应一定达到平衡状态。故选cd。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案